题目内容
14. 某同学欲用下列装置探究碳与浓硫酸的反应,并对气体产物进行检验;
某同学欲用下列装置探究碳与浓硫酸的反应,并对气体产物进行检验;请回答:
(1)仪器A的名称是分液漏斗.
(2)装置C中无水硫酸铜的作用是检验反应生成的水.
(3)下列说法正确的是( )
A、装置D中品红溶液褪色,即可说明有SO2产生
B、装置F中澄清石灰水变浑浊,即可说明有CO2产生
C、装置E中酸性KMnO4溶液的主要作用是除去SO2
D、欲检验CO2的存在必须在E和F之间增加一个盛有品红溶液的洗气瓶.
分析 装置B中从分液漏斗滴入浓硫酸和烧瓶中碳加热反应,生成二氧化碳、二氧化硫和水,通过装置C中无水硫酸铜检验生成的水蒸气,通过装置D中品红溶液检验二氧化硫的存在,通过装置E中高锰酸钾溶液除去二氧化硫,应增加一个盛品红溶液的洗气瓶检验二氧化硫是否除净,最后通入澄清石灰水,变浑浊证明生成二氧化碳气体,
(1)仪器A为添加浓硫酸的分液漏斗;
(2)装置C中无水硫酸铜检验反应生成的水;
(3)A、SO2产生气体具有漂白性,能使品红溶液褪色;
B、装置F中澄清石灰水变浑浊,可能是过量的二氧化硫气体作用,不能说明有CO2产生;
C、SO2具有还原性,可以被高锰酸钾溶液氧化;
D、欲检验CO2的存在必须在D和E之间增加一个盛有品红溶液的洗气瓶.
解答 解:装置B中从分液漏斗滴入浓硫酸和烧瓶中碳加热反应,生成二氧化碳、二氧化硫和水,通过装置C中无水硫酸铜检验生成的水蒸气,通过装置D中品红溶液检验二氧化硫的存在,通过装置E中高锰酸钾溶液除去二氧化硫,应增加一个盛品红溶液的洗气瓶检验二氧化硫是否除净,最后通入澄清石灰水,变浑浊证明生成二氧化碳气体,
(1)仪器A的名称为分液漏斗,
故答案为:分液漏斗;
(2)装置C中无水硫酸铜检验反应生成的水,无水硫酸铜遇到水蒸气变为蓝色,证明生成了水,
故答案为:检验反应生成的水;
(3)A、SO2产生气体具有漂白性,能使品红溶液褪色,装置D中品红溶液褪色,即可说明有SO2产生,故A正确;
B、二氧化硫也可以使石灰水变浑浊,装置F中澄清石灰水变浑浊,可能是过量的二氧化硫气体作用,不能说明有CO2产生,故B错误;
C、SO2具有还原性,可以被高锰酸钾溶液氧化,装置E中酸性KMnO4溶液的主要作用是除去SO2,故C正确;
D、欲检验CO2的存在必须在D和E之间增加一个盛有品红溶液的洗气瓶,检验生成的二氧化硫是否被除净,故D错误;
故答案为:AC.
点评 本题考查了浓硫酸性质的应用,产物验证方法和现象判断,注意二氧化碳、二氧化硫都可以使澄清石灰水变浑浊,题目难度中等.

| A. | 活性炭、SO2、Na2O2都能使品红溶液褪色,但原理不同 | |
| B. | 非金属氧化物不一定是酸性氧化物,金属氧化物多数是碱性氧化物 | |
| C. | 同温同压下,两份相同质量的铁粉,分别与足量的稀硫酸和稀硝酸反应,产生气体的体积不同 | |
| D. | 将SO2气体通入BaCl2溶液中至饱和未见沉淀生成,继续通入NO2则有沉淀生成 |
| A. | 4 种 | B. | 6 种 | C. | 8 种 | D. | 10 种 |
| A. | CH4>SiH4>GeH4>SnH4 | B. | NH3<PH3<AsH3<SbH3 | ||
| C. | H2O>H2S>H2Se>H2Te | D. | HCl<HBr<HI<HF |
| t(min) | 2 | 4.5 | 5 | 6 |
| X转化率 | 30% | 40% | 70% | 70% |
| A. | 随着反应的进行,混合气体的密度不断增大 | |
| B. | 反应在5.5min时,v正(X)=v逆(Z) | |
| C. | 6min时,容器中剩余1.4mol Y | |
| D. | 其他条件不变,将X的物质的量改为10mol,则可得4mol Z |
| A. | 日常生活中使用的硬币都是纯金、白银打造的 | |
| B. | 塑化剂对人体有害,不可用于食品添加剂 | |
| C. | SO2可用于漂白纸张,亦可漂白日常生活中食的馒头 | |
| D. | “药毒三分”其实是没有科学依据的,只要有效超剂里也无所谓 |
| A. | 恒温恒压容器中,反应A(s)+2B(g)?2C(g)达平衡后,再通入气体C,平衡不移动,气体B的浓度保持不变 | |
| B. | 恒温恒容容器中,通入一定量的N2O4,反应N2O4?2NO2(g)达平衡后,再通入N2O4,平衡正向移动,再达平衡时N2O4的转化率增大 | |
| C. | 恒温下,向密闭容器中加入NH2COONH4固体,反应NH2COONH4(s)?2NH3(g)+CO2(g)达平衡后,缩小容器的容积,再达平衡时,CO2的浓度不变 | |
| D. | 恒温恒容容器中,N2(g)+3H2(g)?2NH3(g)达平恒后,改变条件使平衡正向移动,再达平衡时NH3的体积分数一定增大 |
 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义.(1)将CO2与焦炭作用生成CO,CO可用于炼铁等.
①已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1
C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1
则CO还原Fe2O3的热化学方程式为3CO(g)+Fe2O3(s)=2Fe(s)+3CO(g)△H=-28.5kJ•mol-1.
②已知Fe与CO可形成五羰基铁[Fe(CO)5],该化合物相当活泼易吸收H2生成氢化羰基铁.氢化羰基铁为二元弱酸,可与NaOH反应生成四羰基铁酸二钠.试写出五羰基铁吸收H2的反应方程式Fe(CO)5+H2=H2Fe(CO)4+CO.
③利用燃烧反应可设计成CO/O2燃料电池(以KOH溶液为电解液),写出该电池的负极反应式CO-2e-+4OH-=CO32-+2H2O.
(2)某实验将CO2和H2充入一定体积的密闭容器中,在两种不同条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1
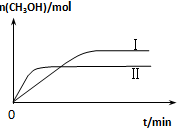
测得CH3OH的物质的量随时间变化如下图所示,回答问题:
①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ大于KⅡ(填“大于”、“等于”或“小于”).
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式投入反应物,一段时间后达到平衡.
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、c molCH3OH(g)、c molH2O(g) |
| A. | 混合气体的压强不变 | B. | 混合气体的密度不变 | ||
| C. | 混合气体的物质的量不变 | D. | A、B、C、D物质的量比为1:2:1:1 |