题目内容
12.设NA为阿伏伽德罗常数的值.下列叙述正确的是( )| A. | 1 L 1 mol•L-1的NaClO 溶液中含有ClO-的数目为NA | |
| B. | 88g乙酸乙酯中存在的共价键总数为NA | |
| C. | 加热时,含2molH2SO4的浓硫酸与足量铜反应,转移的电子数为2NA | |
| D. | 1mol羟基所含的电子数为10NA |
分析 A、次氯酸根在溶液中会水解;
B、求出乙酸乙酯的物质的量,然后根据乙酸乙酯中含14条共价键来分析;
C、铜只和浓硫酸反应,和稀硫酸不反应;
D、-OH中含9个电子.
解答 解:A、ClO-是弱酸根,在溶液中会水解,故在溶液中的个数小于NA个,故A错误;
B、88g乙酸乙酯的物质的量为1mol,而1mol乙酸乙酯中含14mol共价键,即14NA个,故B正确;
C、铜只能与浓硫酸反应,与稀硫酸不反应,故2mol浓硫酸不能完全反应,则转移的电子数小于2NA个,故C错误;
D、羟基不显电性,1mol羟基含9mol电子即9NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
相关题目
2. 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义.
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等.
①已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1
C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1
则CO还原Fe2O3的热化学方程式为3CO(g)+Fe2O3(s)=2Fe(s)+3CO(g)△H=-28.5kJ•mol-1.
②已知Fe与CO可形成五羰基铁[Fe(CO)5],该化合物相当活泼易吸收H2生成氢化羰基铁.氢化羰基铁为二元弱酸,可与NaOH反应生成四羰基铁酸二钠.试写出五羰基铁吸收H2的反应方程式Fe(CO)5+H2=H2Fe(CO)4+CO.
③利用燃烧反应可设计成CO/O2燃料电池(以KOH溶液为电解液),写出该电池的负极反应式CO-2e-+4OH-=CO32-+2H2O.
(2)某实验将CO2和H2充入一定体积的密闭容器中,在两种不同条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1
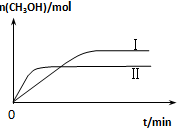
测得CH3OH的物质的量随时间变化如下图所示,回答问题:
①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ大于KⅡ(填“大于”、“等于”或“小于”).
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式投入反应物,一段时间后达到平衡.
若甲中平衡后气体的压强为开始时的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行,则c的取值范围为0.4<c≤1 .
 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义.(1)将CO2与焦炭作用生成CO,CO可用于炼铁等.
①已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1
C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1
则CO还原Fe2O3的热化学方程式为3CO(g)+Fe2O3(s)=2Fe(s)+3CO(g)△H=-28.5kJ•mol-1.
②已知Fe与CO可形成五羰基铁[Fe(CO)5],该化合物相当活泼易吸收H2生成氢化羰基铁.氢化羰基铁为二元弱酸,可与NaOH反应生成四羰基铁酸二钠.试写出五羰基铁吸收H2的反应方程式Fe(CO)5+H2=H2Fe(CO)4+CO.
③利用燃烧反应可设计成CO/O2燃料电池(以KOH溶液为电解液),写出该电池的负极反应式CO-2e-+4OH-=CO32-+2H2O.
(2)某实验将CO2和H2充入一定体积的密闭容器中,在两种不同条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1
测得CH3OH的物质的量随时间变化如下图所示,回答问题:
①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ大于KⅡ(填“大于”、“等于”或“小于”).
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式投入反应物,一段时间后达到平衡.
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、c molCH3OH(g)、c molH2O(g) |
3.在一定温度下的定容密闭容器中,表明反应:A(s)+2B(g)?C(g)+D(g)已达平衡的是( )
| A. | 混合气体的压强不变 | B. | 混合气体的密度不变 | ||
| C. | 混合气体的物质的量不变 | D. | A、B、C、D物质的量比为1:2:1:1 |
17.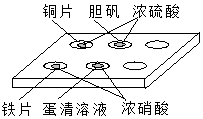 在如图所示的实验中,对点滴板上的现象描述正确的是( )
在如图所示的实验中,对点滴板上的现象描述正确的是( )
①装有铜片的孔穴中溶液呈蓝色
②装有胆矾的孔穴中固体的颜色变浅
③装有铁片的孔穴中溶液呈浅绿色
④装有铁片的孔穴中溶液呈浅黄色
⑤装有蛋清溶液的孔穴中呈浅黄色.
 在如图所示的实验中,对点滴板上的现象描述正确的是( )
在如图所示的实验中,对点滴板上的现象描述正确的是( )①装有铜片的孔穴中溶液呈蓝色
②装有胆矾的孔穴中固体的颜色变浅
③装有铁片的孔穴中溶液呈浅绿色
④装有铁片的孔穴中溶液呈浅黄色
⑤装有蛋清溶液的孔穴中呈浅黄色.
| A. | ①④ | B. | ②③ | C. | ①⑤ | D. | ②⑤ |
4. 文艺复兴时期,群青颜料曾用在许多著名的油画上,当时群青颜料是由贵重的青金石研磨并制成的.青金石是指碱性铝硅酸盐矿物,其中含钠、铝、硅、硫、氯、氧等元素.
文艺复兴时期,群青颜料曾用在许多著名的油画上,当时群青颜料是由贵重的青金石研磨并制成的.青金石是指碱性铝硅酸盐矿物,其中含钠、铝、硅、硫、氯、氧等元素.
(1)硅元素基态原子的价电子轨道表示式为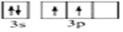 .
.
(2)第四周期中,与铝未成对电子数相同的金属元素有4种.
(3)Na+和Ne互为等电子体,电离能I2(Na)> I1(Ne)(填“>”或“<”).
(4)①已知氯有多种含氧酸,其电离平衡常数如下:
HClO4的结构简式为 ,HClO3中Cl原子的杂化轨道类型为sp3,HClO2中含有的共价键类型为σ键和π键.以上几种含氧酸的酸性强弱不同,其原因为几种含氧酸的酸性强弱不同,其原因为.
,HClO3中Cl原子的杂化轨道类型为sp3,HClO2中含有的共价键类型为σ键和π键.以上几种含氧酸的酸性强弱不同,其原因为几种含氧酸的酸性强弱不同,其原因为.
②氢卤酸(HX)的电离过程如图.△H1和△H2的递变规律都是HF>HCl>HBr>HI,其中△H1(HF)特别大的原因为HF分子与水分子间存在氢键,电离时需要更多能量,影响△H2递变的因素为键能.
(5)铝单质为面心立方晶体,晶胞参数a=q nm,铝的摩尔质量为Mg•mol-1,原子半径为r pm,阿伏伽德罗常数的值为NA.则铝单质的密度为$\frac{4M}{{N}_{A}×{q}^{3}×1{0}^{-21}}$ g•cm-3(列式即可,下同),铝晶胞中原子的体积占晶胞体积的百分率为$\frac{4×\frac{4}{3}π{r}^{3}}{{q}^{3}×1{0}^{9}}$.
 文艺复兴时期,群青颜料曾用在许多著名的油画上,当时群青颜料是由贵重的青金石研磨并制成的.青金石是指碱性铝硅酸盐矿物,其中含钠、铝、硅、硫、氯、氧等元素.
文艺复兴时期,群青颜料曾用在许多著名的油画上,当时群青颜料是由贵重的青金石研磨并制成的.青金石是指碱性铝硅酸盐矿物,其中含钠、铝、硅、硫、氯、氧等元素.(1)硅元素基态原子的价电子轨道表示式为
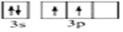 .
.(2)第四周期中,与铝未成对电子数相同的金属元素有4种.
(3)Na+和Ne互为等电子体,电离能I2(Na)> I1(Ne)(填“>”或“<”).
(4)①已知氯有多种含氧酸,其电离平衡常数如下:
| 化学式 | HClO4 | HClO3 | HClO2 | HClO |
| Ka | 1×1010 | 1×101 | 1×10-2 | 4×10-8 |
 ,HClO3中Cl原子的杂化轨道类型为sp3,HClO2中含有的共价键类型为σ键和π键.以上几种含氧酸的酸性强弱不同,其原因为几种含氧酸的酸性强弱不同,其原因为.
,HClO3中Cl原子的杂化轨道类型为sp3,HClO2中含有的共价键类型为σ键和π键.以上几种含氧酸的酸性强弱不同,其原因为几种含氧酸的酸性强弱不同,其原因为.②氢卤酸(HX)的电离过程如图.△H1和△H2的递变规律都是HF>HCl>HBr>HI,其中△H1(HF)特别大的原因为HF分子与水分子间存在氢键,电离时需要更多能量,影响△H2递变的因素为键能.
(5)铝单质为面心立方晶体,晶胞参数a=q nm,铝的摩尔质量为Mg•mol-1,原子半径为r pm,阿伏伽德罗常数的值为NA.则铝单质的密度为$\frac{4M}{{N}_{A}×{q}^{3}×1{0}^{-21}}$ g•cm-3(列式即可,下同),铝晶胞中原子的体积占晶胞体积的百分率为$\frac{4×\frac{4}{3}π{r}^{3}}{{q}^{3}×1{0}^{9}}$.
1.化学与生产、生活、环境等密切相关.下列叙述正确的是( )
| A. | 加强化石燃料的开采利用,能从根本上解决能源危机 | |
| B. | 苹果放在空气中久置变黄和纸张在空气中久置变黄原理相似 | |
| C. | 从海水中提取物质,都必须经过化学反应才能实现 | |
| D. | 焙制糕点的发酵粉主要成分之一是碳酸氢纳,它也是治疗胃酸过多的一种药剂 |
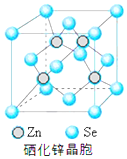 硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物.
硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物.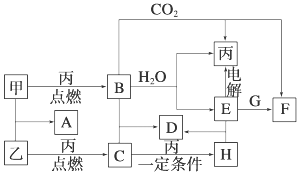
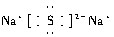 .
.