题目内容
14. 如图装置,a为铁电极,b为石墨电极,烧杯中的物质为水或某种溶液,两电极可直接相连或接直流电源,则石墨电极上可能发生的反应有( )
如图装置,a为铁电极,b为石墨电极,烧杯中的物质为水或某种溶液,两电极可直接相连或接直流电源,则石墨电极上可能发生的反应有( )①2H++2e-═H2 ②O2+2H2O+4e-═4OH-③4OH-═O2+2H2O+4e-.
| A. | ① | B. | ② | C. | ①② | D. | ①②③ |
分析 如果两者直接相连,如果电解质溶液为酸,则石墨电极上可能发生2H++2e-═H2↑;如果电解质是中性或弱酸性发生吸氧腐蚀,则石墨电极上可能发生:O2+2H2O+4e-═4OH-;如果石墨极接直流电源的正极,电解质为硫酸钠溶液,则阳极发生4OH-═O2+2H2O+4e-,由此分析解答.
解答 解:如果两者直接相连,如果电解质溶液为酸,则石墨电极上可能发生2H++2e-═H2↑;如果电解质是中性或弱酸性发生吸氧腐蚀,则石墨电极上可能发生:O2+2H2O+4e-═4OH-;如果石墨极接直流电源的正极,电解质为硫酸钠溶液,则阳极发生4OH-═O2+2H2O+4e-,所以①②③都可以发生,
故选D.
点评 本题考查原电池和电解池原理,根据电极上得失电子来分析解答,明确原电池的工作原理及电解质溶液的性质是解答本题的关键,电解过程的反应原理应用,注意相关基础知识的积累,难度不大.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
相关题目
5.分子式为C4H10O的醇与分子式为C4H8O2的羧酸发生酯化反应,生成酯的结构可能有(不考虑立体异构)( )
| A. | 4 种 | B. | 6 种 | C. | 8 种 | D. | 10 种 |
6.下列说法正确的是( )
| A. | 恒温恒压容器中,反应A(s)+2B(g)?2C(g)达平衡后,再通入气体C,平衡不移动,气体B的浓度保持不变 | |
| B. | 恒温恒容容器中,通入一定量的N2O4,反应N2O4?2NO2(g)达平衡后,再通入N2O4,平衡正向移动,再达平衡时N2O4的转化率增大 | |
| C. | 恒温下,向密闭容器中加入NH2COONH4固体,反应NH2COONH4(s)?2NH3(g)+CO2(g)达平衡后,缩小容器的容积,再达平衡时,CO2的浓度不变 | |
| D. | 恒温恒容容器中,N2(g)+3H2(g)?2NH3(g)达平恒后,改变条件使平衡正向移动,再达平衡时NH3的体积分数一定增大 |
2. 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义.
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等.
①已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1
C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1
则CO还原Fe2O3的热化学方程式为3CO(g)+Fe2O3(s)=2Fe(s)+3CO(g)△H=-28.5kJ•mol-1.
②已知Fe与CO可形成五羰基铁[Fe(CO)5],该化合物相当活泼易吸收H2生成氢化羰基铁.氢化羰基铁为二元弱酸,可与NaOH反应生成四羰基铁酸二钠.试写出五羰基铁吸收H2的反应方程式Fe(CO)5+H2=H2Fe(CO)4+CO.
③利用燃烧反应可设计成CO/O2燃料电池(以KOH溶液为电解液),写出该电池的负极反应式CO-2e-+4OH-=CO32-+2H2O.
(2)某实验将CO2和H2充入一定体积的密闭容器中,在两种不同条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1
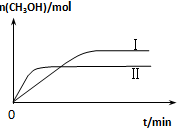
测得CH3OH的物质的量随时间变化如下图所示,回答问题:
①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ大于KⅡ(填“大于”、“等于”或“小于”).
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式投入反应物,一段时间后达到平衡.
若甲中平衡后气体的压强为开始时的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行,则c的取值范围为0.4<c≤1 .
 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义.(1)将CO2与焦炭作用生成CO,CO可用于炼铁等.
①已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1
C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1
则CO还原Fe2O3的热化学方程式为3CO(g)+Fe2O3(s)=2Fe(s)+3CO(g)△H=-28.5kJ•mol-1.
②已知Fe与CO可形成五羰基铁[Fe(CO)5],该化合物相当活泼易吸收H2生成氢化羰基铁.氢化羰基铁为二元弱酸,可与NaOH反应生成四羰基铁酸二钠.试写出五羰基铁吸收H2的反应方程式Fe(CO)5+H2=H2Fe(CO)4+CO.
③利用燃烧反应可设计成CO/O2燃料电池(以KOH溶液为电解液),写出该电池的负极反应式CO-2e-+4OH-=CO32-+2H2O.
(2)某实验将CO2和H2充入一定体积的密闭容器中,在两种不同条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1
测得CH3OH的物质的量随时间变化如下图所示,回答问题:
①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ大于KⅡ(填“大于”、“等于”或“小于”).
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式投入反应物,一段时间后达到平衡.
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、c molCH3OH(g)、c molH2O(g) |
19.下列反应的反应热△H>0的是( )
| A. | 铁与稀硫酸反应 | B. | 加热氧化银冶炼银 | ||
| C. | 醋酸与氨水反应 | D. | 管道煤气燃烧 |
3.在一定温度下的定容密闭容器中,表明反应:A(s)+2B(g)?C(g)+D(g)已达平衡的是( )
| A. | 混合气体的压强不变 | B. | 混合气体的密度不变 | ||
| C. | 混合气体的物质的量不变 | D. | A、B、C、D物质的量比为1:2:1:1 |
4. 文艺复兴时期,群青颜料曾用在许多著名的油画上,当时群青颜料是由贵重的青金石研磨并制成的.青金石是指碱性铝硅酸盐矿物,其中含钠、铝、硅、硫、氯、氧等元素.
文艺复兴时期,群青颜料曾用在许多著名的油画上,当时群青颜料是由贵重的青金石研磨并制成的.青金石是指碱性铝硅酸盐矿物,其中含钠、铝、硅、硫、氯、氧等元素.
(1)硅元素基态原子的价电子轨道表示式为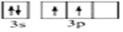 .
.
(2)第四周期中,与铝未成对电子数相同的金属元素有4种.
(3)Na+和Ne互为等电子体,电离能I2(Na)> I1(Ne)(填“>”或“<”).
(4)①已知氯有多种含氧酸,其电离平衡常数如下:
HClO4的结构简式为 ,HClO3中Cl原子的杂化轨道类型为sp3,HClO2中含有的共价键类型为σ键和π键.以上几种含氧酸的酸性强弱不同,其原因为几种含氧酸的酸性强弱不同,其原因为.
,HClO3中Cl原子的杂化轨道类型为sp3,HClO2中含有的共价键类型为σ键和π键.以上几种含氧酸的酸性强弱不同,其原因为几种含氧酸的酸性强弱不同,其原因为.
②氢卤酸(HX)的电离过程如图.△H1和△H2的递变规律都是HF>HCl>HBr>HI,其中△H1(HF)特别大的原因为HF分子与水分子间存在氢键,电离时需要更多能量,影响△H2递变的因素为键能.
(5)铝单质为面心立方晶体,晶胞参数a=q nm,铝的摩尔质量为Mg•mol-1,原子半径为r pm,阿伏伽德罗常数的值为NA.则铝单质的密度为$\frac{4M}{{N}_{A}×{q}^{3}×1{0}^{-21}}$ g•cm-3(列式即可,下同),铝晶胞中原子的体积占晶胞体积的百分率为$\frac{4×\frac{4}{3}π{r}^{3}}{{q}^{3}×1{0}^{9}}$.
 文艺复兴时期,群青颜料曾用在许多著名的油画上,当时群青颜料是由贵重的青金石研磨并制成的.青金石是指碱性铝硅酸盐矿物,其中含钠、铝、硅、硫、氯、氧等元素.
文艺复兴时期,群青颜料曾用在许多著名的油画上,当时群青颜料是由贵重的青金石研磨并制成的.青金石是指碱性铝硅酸盐矿物,其中含钠、铝、硅、硫、氯、氧等元素.(1)硅元素基态原子的价电子轨道表示式为
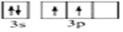 .
.(2)第四周期中,与铝未成对电子数相同的金属元素有4种.
(3)Na+和Ne互为等电子体,电离能I2(Na)> I1(Ne)(填“>”或“<”).
(4)①已知氯有多种含氧酸,其电离平衡常数如下:
| 化学式 | HClO4 | HClO3 | HClO2 | HClO |
| Ka | 1×1010 | 1×101 | 1×10-2 | 4×10-8 |
 ,HClO3中Cl原子的杂化轨道类型为sp3,HClO2中含有的共价键类型为σ键和π键.以上几种含氧酸的酸性强弱不同,其原因为几种含氧酸的酸性强弱不同,其原因为.
,HClO3中Cl原子的杂化轨道类型为sp3,HClO2中含有的共价键类型为σ键和π键.以上几种含氧酸的酸性强弱不同,其原因为几种含氧酸的酸性强弱不同,其原因为.②氢卤酸(HX)的电离过程如图.△H1和△H2的递变规律都是HF>HCl>HBr>HI,其中△H1(HF)特别大的原因为HF分子与水分子间存在氢键,电离时需要更多能量,影响△H2递变的因素为键能.
(5)铝单质为面心立方晶体,晶胞参数a=q nm,铝的摩尔质量为Mg•mol-1,原子半径为r pm,阿伏伽德罗常数的值为NA.则铝单质的密度为$\frac{4M}{{N}_{A}×{q}^{3}×1{0}^{-21}}$ g•cm-3(列式即可,下同),铝晶胞中原子的体积占晶胞体积的百分率为$\frac{4×\frac{4}{3}π{r}^{3}}{{q}^{3}×1{0}^{9}}$.
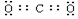 .
.