题目内容
15.请回忆NaCl晶体的晶胞结构,已知NaCl的密度为ag•cm-3,其摩尔质量为bg•mol-1,阿伏伽德罗常数的数值为N0,则在NaCl晶体中Na+和Cl-的核间距大约是$\frac{1}{2}$×$\root{3}{\frac{\frac{b}{NA}×4}{a}}$cm..分析 氯化钠晶胞结构如图所示: ,该晶胞中钠离子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,氯离子个数=12×$\frac{1}{4}$+1=4,晶胞体积=$\frac{\frac{b}{NA}×4}{a}$cm3,晶胞棱长=$\root{3}{\frac{\frac{b}{NA}×4}{a}}$cm,食盐晶体里Na+和Cl-的间距为棱长的一半,据此分析解答.
,该晶胞中钠离子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,氯离子个数=12×$\frac{1}{4}$+1=4,晶胞体积=$\frac{\frac{b}{NA}×4}{a}$cm3,晶胞棱长=$\root{3}{\frac{\frac{b}{NA}×4}{a}}$cm,食盐晶体里Na+和Cl-的间距为棱长的一半,据此分析解答.
解答 解:该晶胞中钠离子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,氯离子个数=12×$\frac{1}{4}$+1=4,晶胞体积=$\frac{\frac{b}{NA}×4}{a}$cm3,晶胞棱长=$\root{3}{\frac{\frac{b}{NA}×4}{a}}$cm,食盐晶体里Na+和Cl-的间距为棱长的一半,食盐晶体里Na+和Cl-的间距为棱长的一半=$\frac{1}{2}$×$\root{3}{\frac{\frac{b}{NA}×4}{a}}$cm,
故答案为:$\frac{1}{2}$×$\root{3}{\frac{\frac{b}{NA}×4}{a}}$cm.
点评 本题考查晶胞计算,为高频考点也是学习难点,侧重考查学生空间想象能力及计算能力,知道密度公式中各个字母含义是解本题关键,结合均摊法解答,题目难度中等.

练习册系列答案
相关题目
3.铅蓄电池的电极材料分别为Pb和PbO2,电解质溶液为30%H2SO4,下图是处于工作状态的铅蓄电池示意图,若两电极的质量增加且a极增加得更多.下列说法正确的是( )

| A. | 该铅蓄电池正在充电 | |
| B. | 工作一段时间后,溶液的pH不断减小 | |
| C. | a为铅蓄电池的正极 | |
| D. | b电极发生的反应为PbO2+4H++SO42-+2e-═PbSO4+2H2O |
20.下列说法正确的是( )
| A. | 赤铁矿、磁铁矿、黄铁矿、孔雀石都是常见的铁矿石 | |
| B. | 纤维素、PLA(聚乳酸)、维生素C、硝化纤维等都是高分子化合物 | |
| C. | 高容量的储氢材料的研制是推广应用燃料电池的关键问题之一 | |
| D. | 将呼吸产生的二氧化碳用石灰水吸收符合”低碳经济“原则 |
6.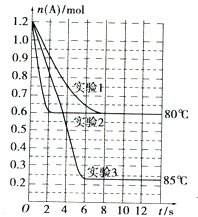 将1.2mol的A气体充入2L恒容密闭容器中发生反应:A(g)?2B(g).在三种不同条件下进行实验,A的物质的量随时间的变化如图所示.试回答下列问题:
将1.2mol的A气体充入2L恒容密闭容器中发生反应:A(g)?2B(g).在三种不同条件下进行实验,A的物质的量随时间的变化如图所示.试回答下列问题:
(1)实验1中,4s时A的转化率为37.5%;此条件下该反应的平衡常数K1的值为1.2mol/L.
(2)实验2与实验1对比,其可能隐含的反应条件是使用催化剂.
(3)根据实验3与实验1的图象比较,可推测该反应是吸热(填“放热”或“吸热”)反应.设实验1~3的平衡常数的值分别为K1、K2、K3,则它们之间的关系为K1=K2<K3(填“>”、“<”或“=”).
(4)为了验证增大催化剂的表面积、增大压强可提高化学反应速率这一结论,某同学在实验1的基础上又利用该容器设计了实验4和实验5,部分实验条件及数据见下表.请将表格补充完整
 将1.2mol的A气体充入2L恒容密闭容器中发生反应:A(g)?2B(g).在三种不同条件下进行实验,A的物质的量随时间的变化如图所示.试回答下列问题:
将1.2mol的A气体充入2L恒容密闭容器中发生反应:A(g)?2B(g).在三种不同条件下进行实验,A的物质的量随时间的变化如图所示.试回答下列问题:(1)实验1中,4s时A的转化率为37.5%;此条件下该反应的平衡常数K1的值为1.2mol/L.
(2)实验2与实验1对比,其可能隐含的反应条件是使用催化剂.
(3)根据实验3与实验1的图象比较,可推测该反应是吸热(填“放热”或“吸热”)反应.设实验1~3的平衡常数的值分别为K1、K2、K3,则它们之间的关系为K1=K2<K3(填“>”、“<”或“=”).
(4)为了验证增大催化剂的表面积、增大压强可提高化学反应速率这一结论,某同学在实验1的基础上又利用该容器设计了实验4和实验5,部分实验条件及数据见下表.请将表格补充完整
| 实验编号 及其目的 | V(容积)/L | t/℃ | n(A起始)/mol | n(B起始)/mol | 催化剂的质量/g | 催化剂的表面积/m2•g-1[来源:Z.xx.k.Com] |
| 实验1 参照对比实验 | 2 | 80 | 1.2 | 0 | a | b |
| 实验4:催化剂的表面积对反应速率的影响 | | | | | | |
| 实验5目的: | 1 | | | | | |
3. 通过电解饱和食盐水得到的氢氧化钠固体样品常含有氯化钠杂质.来来同学利用中和滴定原理测定氢氧化钠的质量分数.步骤为:
通过电解饱和食盐水得到的氢氧化钠固体样品常含有氯化钠杂质.来来同学利用中和滴定原理测定氢氧化钠的质量分数.步骤为:
①称取15.000g氢氧化钠固体样品,加水溶解,配成200mL溶液;
②用4.80%(密度是1.02g/mL)的盐酸滴定.以下是实验数据记录表:
(1)请根据如图(滴定管局部)读出第2次实验的末读数,填充上表中的两个空格.
(2)计算4.80%(密度是1.02g/mL)盐酸的物质的量浓度(精确至0.0001).
(3)计算氢氧化钠固体样品中氢氧化钠的质量分数.
 通过电解饱和食盐水得到的氢氧化钠固体样品常含有氯化钠杂质.来来同学利用中和滴定原理测定氢氧化钠的质量分数.步骤为:
通过电解饱和食盐水得到的氢氧化钠固体样品常含有氯化钠杂质.来来同学利用中和滴定原理测定氢氧化钠的质量分数.步骤为:①称取15.000g氢氧化钠固体样品,加水溶解,配成200mL溶液;
②用4.80%(密度是1.02g/mL)的盐酸滴定.以下是实验数据记录表:
| 实验序号 | 待测样品溶液体积(mL) | 滴定管读数 | 消耗标准盐酸溶液的体积(mL) | |
| 初读数 | 末读数 | |||
| 1 | 20.00 | 0.00 | 19.95 | 19.95 |
| 2 | 20.00 | 0.05 | 19.90mL | 19.85mL |
(2)计算4.80%(密度是1.02g/mL)盐酸的物质的量浓度(精确至0.0001).
(3)计算氢氧化钠固体样品中氢氧化钠的质量分数.
4.用下列实验装置进行相应实验,能达到实验目的是( )


| A. | 用图甲的方法不能检查此装置的气密性 | |
| B. | 图乙可以作为CCl4萃取溴水后的分液装置 | |
| C. | 实验室用图丙所示装置制取少量氨气 | |
| D. | 图丁洗气瓶中的白色沉淀为BaSO3 |
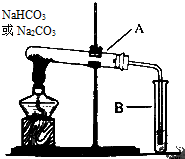 某校化学兴趣小组,通过如图装置探究Na2CO3和NaHCO3的热稳定性,探究方案设计如下,请你参与并完成该探究方案.
某校化学兴趣小组,通过如图装置探究Na2CO3和NaHCO3的热稳定性,探究方案设计如下,请你参与并完成该探究方案.
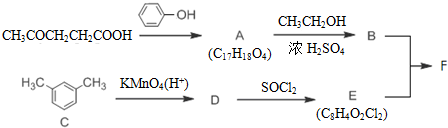
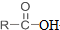 +SOCl2→
+SOCl2→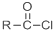 +SO2+HCl
+SO2+HCl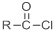 +R′OH→
+R′OH→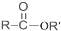 +HCl(R、R′表示烃基)
+HCl(R、R′表示烃基)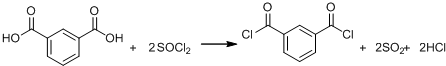 .
.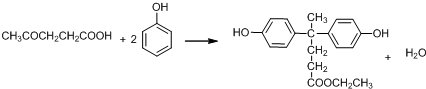 .
. 结构.
结构.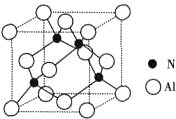 由N元素和Al元素形成的化合物的晶胞如图所示,已知N原子位于晶胞体对角线的$\frac{1}{4}$处.假设该化合物的密度为ρg•cm-3,则晶胞中最近的两个N原子之间的距离为$\frac{\sqrt{2}}{2}$$\root{3}{\frac{164}{{N}_{A}ρ}}$.
由N元素和Al元素形成的化合物的晶胞如图所示,已知N原子位于晶胞体对角线的$\frac{1}{4}$处.假设该化合物的密度为ρg•cm-3,则晶胞中最近的两个N原子之间的距离为$\frac{\sqrt{2}}{2}$$\root{3}{\frac{164}{{N}_{A}ρ}}$.