题目内容
10.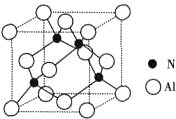 由N元素和Al元素形成的化合物的晶胞如图所示,已知N原子位于晶胞体对角线的$\frac{1}{4}$处.假设该化合物的密度为ρg•cm-3,则晶胞中最近的两个N原子之间的距离为$\frac{\sqrt{2}}{2}$$\root{3}{\frac{164}{{N}_{A}ρ}}$.
由N元素和Al元素形成的化合物的晶胞如图所示,已知N原子位于晶胞体对角线的$\frac{1}{4}$处.假设该化合物的密度为ρg•cm-3,则晶胞中最近的两个N原子之间的距离为$\frac{\sqrt{2}}{2}$$\root{3}{\frac{164}{{N}_{A}ρ}}$.
分析 根据晶胞的结构可知,每个晶胞中含有N原子数为4,Al原子数为$\frac{1}{8}$×$8+\frac{1}{2}×6$=4,根据$ρ=\frac{m}{V}$可计算出晶胞的体积,进而确定晶胞的边长,N原子位于晶胞体对角线的$\frac{1}{4}$处,所以晶胞中最近的两个N原子之间的距离为面对角线的$\frac{1}{2}$,据此答题.
解答 解:根据晶胞的结构可知,每个晶胞中含有N原子数为4,Al原子数为$\frac{1}{8}$×$8+\frac{1}{2}×6$=4,根据$ρ=\frac{m}{V}$可知晶胞的体积为$\frac{\frac{4×41}{{N}_{A}}}{ρ}$=$\frac{164}{{N}_{A}ρ}$,所以晶胞的边长为$\root{3}{\frac{164}{{N}_{A}ρ}}$,则晶胞的面对角线长为$\sqrt{2}$×$\root{3}{\frac{164}{{N}_{A}ρ}}$,N原子位于晶胞体对角线的$\frac{1}{4}$处,所以晶胞中最近的两个N原子之间的距离为面对角线的$\frac{1}{2}$,所以胞中最近的两个N原子之间的距离为$\frac{\sqrt{2}}{2}$$\root{3}{\frac{164}{{N}_{A}ρ}}$,
故答案为:$\frac{\sqrt{2}}{2}$$\root{3}{\frac{164}{{N}_{A}ρ}}$.
点评 本题考查晶胞计算及晶胞的结构,难点是均摊法的运用,知道密度公式中各个字母含义,题目难度中等,注意立体几何知识的灵活运用.

练习册系列答案
相关题目
18.镇痛剂M(苯佐卡因)结构简式如图,下列说法正确的是( )
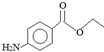

| A. | M分子式为C8H11NO2 | |
| B. | 1mol M与NaOH溶液反应消耗1mol NaOH | |
| C. | M与盐酸的反应属于加成反应 | |
| D. | 与M含有相同官能团的同分异构体有8种 |
5.下列说法正确的是( )
| A. | 2012年,随着两会顺利召开,保障房建设成为热点.住宅建设离不开硅酸盐材料,工业玻璃、水泥、陶瓷都要使用石灰石做原料,钢筋混凝土、玻璃钢、石棉瓦、碳纤维增强陶瓷都是常见的复合材料 | |
| B. | 去年底,世界气候大会在南非德班召开.开发新型能源是践行低碳生活的有效途径之一,生物质能是指来源于动植物及其加工产品所储存的能量 | |
| C. | 近年食品安全倍受关注,某媒体披露“皮革奶”事件.有不法厂商将皮革下脚料水解后掺入奶粉以提高奶粉中蛋白质的含量.动物皮革的主要成分是蛋白质,“皮革奶”灼烧时有烧焦羽毛的气味 | |
| D. | 氯化钙及氯化镁等“化冰盐”是冰融化成水的反应催化剂,在雪地里加入化冰盐可快速消除冰雪 |
1.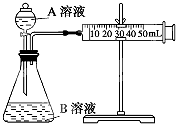 甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素(化学方程式为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O).
甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素(化学方程式为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O).
(1)请写出该反应对应的离子方程式(提示:H2C2O4是弱酸):2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
(2)甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小.
实验装置如图,实验时分液漏斗中A溶液一次性放下,A、B的成分见表:
该实验探究的是温度、浓度、催化剂对化学反应速率的影响.在反应停止之前,相同时间内针管中所得CO2的体积由大到小的顺序是③>④>②>①(用实验序号填空).
(3)乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率的大小.取两支试管对实验①和②分别进行三次实验,测得以下实验数据(从混合振荡均匀开始计时):
实验②中用KMnO4的浓度变化来表示该反应平均反应速率计算的表达式$\frac{4×1{0}^{-3}×0.01}{(4+2)×1{0}^{-3}×14}$mol•L-1•min-1(表达式中要用题中原始数据,无需算出结果,且假设混合溶液体积可以直接相加).若不经过计算,直接看表中的褪色时间长短来判断浓度大小与反应速率的关系是否可行?不可行(填“可行”或“不可行”).若不可行(若认为可行则下空不填),请设计可以通过直接观察褪色时间长短来判断的改进方案取过量且同体积、不同浓度的草酸和同体积同浓度的酸性KMnO4溶液反应.
 甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素(化学方程式为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O).
甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素(化学方程式为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O).(1)请写出该反应对应的离子方程式(提示:H2C2O4是弱酸):2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
(2)甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小.
实验装置如图,实验时分液漏斗中A溶液一次性放下,A、B的成分见表:
| 序号 | T (K) | 催化剂用量(g) | A溶液 | B溶液 |
| ①① | 298 | 0 | 2mL 0.2mol/L H2C2O4溶液 | 4mL 0.001mol/L KMnO4溶液 |
| ②② | 298 | 0 | 2mL 0.2mol/L H2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液 |
| ③③ | 323 | 0.5 | 2mL 0.2mol/L H2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液 |
| ④④ | 298 | 0.5 | 2mL 0.2mol/L H2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液 |
(3)乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率的大小.取两支试管对实验①和②分别进行三次实验,测得以下实验数据(从混合振荡均匀开始计时):
| 实验序号 | 溶液褪色所需时间t(min) | ||
| 第一次 | 第二次 | 第三次 | |
| ①① | 6 | 7 | 7 |
| ②② | 14 | 11 | 14 |
18.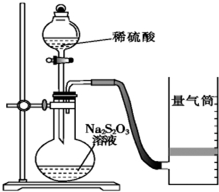 化学反应速率是描述化学反应进行快慢程度的物理量.下面是某同学测定化学反应速率并探究其影响因素的实验.
化学反应速率是描述化学反应进行快慢程度的物理量.下面是某同学测定化学反应速率并探究其影响因素的实验.
Ⅰ.测定化学反应速率
该同学利用如图装置测定化学反应速率.
(已知:S2O32-+2H+═H2O+S↓+SO2↑)
(1)为保证实验准确性、可靠性,利用该装置进行实验前应先进行的步骤是检查装置的气密性;除如图装置所示的实验用品、仪器外,还需要的一件实验仪器是秒表.
(2)若在2min时收集到224mL(已折算成标准状况)气体,可计算出该2min内H+的反应速率,而该测定值比实际值偏小,其原因是SO2会部分溶于水,导致所测得SO2体积偏小.
(3)试简述测定该反应的化学反应速率的其他方法:测定一段时间内生成硫单质的质量或测定一定时间内溶液H+浓度的变化 (写一种).
Ⅱ.为探讨反应物浓度对化学反应速率的影响,设计的实验方案如表.
(已知 I2+2S2O32-═S4O62-+2I-,其中Na2S2O3溶液均足量)
(4)该实验进行的目的是探究反应物浓度(Na2S2O3)对化学反应速率的影响淀粉溶液的作用是作为显色剂,检验I2的存在.表中Vx═4ml,比较t1、t2、t3大小,试推测该实验结论:t1<t2<t3.
 化学反应速率是描述化学反应进行快慢程度的物理量.下面是某同学测定化学反应速率并探究其影响因素的实验.
化学反应速率是描述化学反应进行快慢程度的物理量.下面是某同学测定化学反应速率并探究其影响因素的实验.Ⅰ.测定化学反应速率
该同学利用如图装置测定化学反应速率.
(已知:S2O32-+2H+═H2O+S↓+SO2↑)
(1)为保证实验准确性、可靠性,利用该装置进行实验前应先进行的步骤是检查装置的气密性;除如图装置所示的实验用品、仪器外,还需要的一件实验仪器是秒表.
(2)若在2min时收集到224mL(已折算成标准状况)气体,可计算出该2min内H+的反应速率,而该测定值比实际值偏小,其原因是SO2会部分溶于水,导致所测得SO2体积偏小.
(3)试简述测定该反应的化学反应速率的其他方法:测定一段时间内生成硫单质的质量或测定一定时间内溶液H+浓度的变化 (写一种).
Ⅱ.为探讨反应物浓度对化学反应速率的影响,设计的实验方案如表.
(已知 I2+2S2O32-═S4O62-+2I-,其中Na2S2O3溶液均足量)
| 实验序号 | 体积V/mL | 时间/s | |||
| Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
| ① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
| ② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
| ③ | 6.0 | 2.0 | 4.0 | Vx | |
19.X、Y均为元素周期表中前20号元素,其简单离子的电子层结构相同,下列正确的是( )
| A. | 由mXa+与nYb-得,m+a=n-b | |
| B. | 由mXa+与nYb-得X和Y不同周期 | |
| C. | X、Y一定不是同周期元素 | |
| D. | 若X离子是阴离子,则Y离子一定是阳离子 |