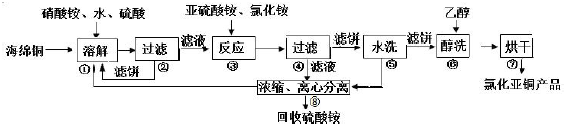
题目内容
5.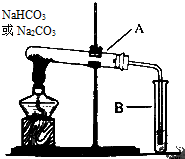 某校化学兴趣小组,通过如图装置探究Na2CO3和NaHCO3的热稳定性,探究方案设计如下,请你参与并完成该探究方案.
某校化学兴趣小组,通过如图装置探究Na2CO3和NaHCO3的热稳定性,探究方案设计如下,请你参与并完成该探究方案.(1)提出假设:Na2CO3或NaHCO3加热分解时可能有CO2生成.
(2)设计实验:①利用如图装置分别对试管A中一定量的Na2CO3和NaHCO3进行加热;②为了检验CO2的生成,试管B中应加入的物质是澄清石灰水.
(填“澄清石灰水”或“NaOH溶液”)
(3)现象与结论:同学们发现只有在加热NaHCO3时,试管B中既能看到气泡又能看到有白色沉淀产生,说明Na2CO3和NaHCO3的热稳定性:Na2CO3> NaHCO3.(填“>”或“<”)
(4)某同学称取8.4gNaHCO3,充分加热,理论上产生CO2气体的体积在标准状态下为1.12L.
分析 (2)检验二氧化碳的常用试剂为澄清石灰水,二氧化碳与氢氧化钠溶液的反应没有明显现象;
(3)碳酸氢钠分解生成的二氧化碳与氢氧化钙反应生成碳酸钙白色沉淀;
(4)根据反应关系式计算出生成的二氧化碳气体在标况下的体积.
解答 解:(2)由于氢氧化钠溶液与二氧化碳的反应没有明显现象,所以无法检验是否有二氧化碳生成,检验二氧化碳气体的常用试剂为澄清石灰水,将二氧化碳气体通入澄清石灰水,澄清石灰水会变浑浊,
故答案为:澄清石灰水;
(3)碳酸钠加热不分解,而碳酸氢钠加热分解生成二氧化碳气体,二氧化碳通入澄清石灰水后,溶液变浑浊,生成了白色沉淀碳酸钙,说明碳酸钠稳定性>碳酸氢钠,
故答案为:>;
(4)碳酸氢钠分解的关系式为:2NaHCO3~CO2,8.4gNaHCO3的物质的量为$\frac{8.4g}{84g/mol}$=0.1mol,完全分解可以生成0.05mol二氧化碳,标况下0.05mol二氧化碳的体积为:22.4L/mol×0.05mol=1.12L,
故答案为:1.12.
点评 本题考查物质的性质实验设计,为高频考点,把握握碳酸钠、碳酸氢钠的热稳定性、反应方程式的计算等为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
15.日常生活和工业生产中常用到漂白剂.下列物质没有漂白作用的是( )
| A. | H2O2 | B. | 新制氯水 | C. | CaCl2 | D. | SO2 |
13.下列反应属于吸热反应的是( )
| A. | 石灰石在高温下的分解反应 | B. | 金属钠和水的反应 | ||
| C. | 盐酸与氢氧化钠溶液的反应 | D. | 铝热反应 |
17.巧妙的实验设计有助于更好地解决问题.下列装置不能达到实验目的是( )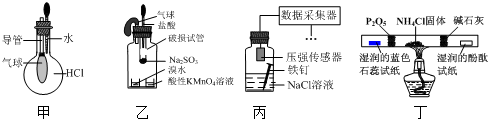

| A. | 用装置甲验证HCl气体易溶于水 | |
| B. | 用装置乙验证SO2具有漂白性 | |
| C. | 用装置丙采集到的压强数据判断铁钉发生析氢腐蚀还是吸氧腐蚀 | |
| D. | 用装置丁检验NH4Cl分解产生的气体 |
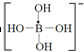 .
.