题目内容
15.汽车尾气中的NOx是大气污染物之一,科学家们在尝试用更科学的方法将NOx转化成无毒物质,从而减少汽车尾气污染.(1)压缩天然气(CNG)汽车的优点之一是利用催化技术能够将NOx转变成无毒的CO2和N2.
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2
③CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H3
则△H1、△H2、△H3三者关系式为△H3 =$\frac{△{H}_{1}+△{H}_{2}}{2}$.
(2)在恒压下,将CH4(g)和NO2(g)置于密闭容器中发生化学反应③,在不同温度、不同投料比时,NO2的平衡转化率见下表:
| 投料比[n(NO2):n(CH4)] | 400K | 500K | 600K |
| 1 | 60% | 43% | 28% |
| 2 | 45% | 33% | 20% |
②若温度不变,提高[n(NO2):n(CH4)]投料比,则K将不变.(填“增大”、“减小”或“不变”)
③400K时,将投料比为1的NO2和CH4的混合气体共0.04mol,充入一装有催化剂的5L容器中,10分钟达到平衡,则NO2的化学反应速率为0.00024mol/L•min.
(3)连续自动监测氮氧化物(NOx)的仪器动态库仑仪的工作原理示意图如图1
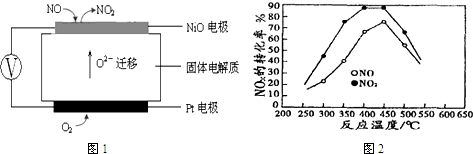
①NiO电极上NO发生的电极反应式NO-2e-+O2-═NO2.
②收集某汽车尾气经测量NOx的含量为1.12%(体积分数),若用甲烷将其完全转化为无害气体,处理1104L(标准状况下)该尾气需要甲烷30g,则尾气中n(NO):n(NO2)=1:1.
(4)在容积相同的两个密闭容器内(装有等量的某种催化剂)先各通入等量的CH4,然后再分别充入等量的NO和NO2.在不同温度下,同时分别发生②③两个反应:并在t秒时测定其中NOx转化率,绘得图象如图2所示:
①从图中可以得出的结论是:
结论一:相同温度下NO转化效率比NO2的低
结论二:在250℃-450℃时,NOx转化率随温度升高而增大,450℃-600℃时NOx转化率随温度升高而减小
结论二的原因是在250°C-450°C时,NOx转化率随温度升高而增大,反应正向进行,400°C左右达到最大,反应达到平衡,450°C-600°C时NOx转化率随温度升高而减小,反应是放热反应,升温平衡逆向进行,二氧化氮转化率减小.
②在上述NO2和CH4反应中,提高NO2转化率的措施有BCF.(填编号)
A.改用高效催化剂 B.降低温度 C.分离出H2O(g) D.增大压强
E.增加原催化剂的表面积 F.减小投料比[n(NO2):n(CH4)].
分析 (1)依据热化学方程式和盖斯定律计算得到所需让化学方程式,①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1<0
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2<0
③CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H3=
依据盖斯定律 $\frac{①+②}{2}$得到目标方程式③;
(2)①依据化学方程式结合平衡常数概念书写平衡常数表达式,平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积;
②平衡常数随温度变化,不随浓度变化;
③400K时,将投料比为1的NO2和CH4的混合气体共0.04mol,二氧化氮转化率为60%,依据化学平衡三段式列式计算;
(3)①根据图片知,铂电极上氧气得电子发生还原反应而作正极,NiO电极上NO失电子发生氧化反应,则NiO为负极,正极上电极反应式为:O2+4e-═2O2-,负极上电极反应式为:NO-2e-+O2-═NO2,结合电池内部离子移动方向判断.
②依据一氧化氮、二氧化氮变化为氮气,甲烷变化为二氧化碳过程中电子转移守恒列式计算;
(4)①根据图象分析,开始二氧化氮转化率增大,反应正向进行,400°C左右达到最大,继续加热,二氧化氮转化率减小,反应是放热反应,说明平衡逆向进行;
②根据外界条件对化学平衡的影响分析.
解答 解:(1)①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1<0
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2<0
③CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H3=
依据盖斯定律 $\frac{①+②}{2}$得到目标方程式③,所以,CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H3=$\frac{△{H}_{1}+△{H}_{2}}{2}$,
故答案为:△H3=$\frac{△{H}_{1}+△{H}_{2}}{2}$;
(2)①在恒压下,将CH4(g)和NO2(g)置于密闭容器中发生化学反应③CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g),反应的平衡常数表达式是利用平衡状态生成物浓度幂次方乘积除以反应物浓度幂次方乘积,该反应的平衡常数的表达式 K=$\frac{c({N}_{2}){c}^{2}({H}_{2}O)c(C{O}_{2})}{c(C{H}_{4}){c}^{2}(N{O}_{2})}$,
故答案为:$\frac{c({N}_{2}){c}^{2}({H}_{2}O)c(C{O}_{2})}{c(C{H}_{4}){c}^{2}(N{O}_{2})}$;
②平衡常数K不受浓度和压强的影响,只受温度的影响,温度不变K不变,故答案为:不变;
③400 K时,将投料比为1的NO2和CH4的混合气体共0.04 mol,二氧化氮转化率为60%,充入一装有催化剂的容器中,充分反应后,则
CH4(g)+2NO2(g)$\frac{\underline{催化剂}}{△}$ N2(g)+CO2(g)+2H2O(g)
n始 0.02 0.02 0 0 0
n转 0.006 0.02×0.6=0.012 0.006 0.006 0.012
n平 0.014 0.008 0.006 0.006 0.012
平衡时NO2的反应速率=$\frac{0.012mol}{5L×1Omin}$=0.00024mol/L•min,
故答案为:0.00024mol/L•min;
(3)①负极NiO上一氧化氮失电子和氧离子反应生成二氧化氮,电极反应式为NO-2e-+O2-═NO2,故答案为:NO-2e-+O2-═NO2;
②收集某汽车尾气经测量NOx的含量为1.12%(体积分数),若用甲烷将其完全转化为无害气体,处理1×104L(标准状况下)该尾气需要甲烷30g,设尾气中NO物质的量为x,NO2物质的量为y,2NO~N2~4e-,2NO2~N2~4e-,CH4~CO2~8e-,
2x+4y=$\frac{30g}{16g/mol}$×8=15mol
x+y=$\frac{1×1{0}^{4}L×1.12%}{22.4L/mol}$=5mol
计算得到x=2.5mol,y=2.5mol
尾气中V(NO):V(NO2)=1:1
故答案为;1:1;
(4)①通过图象知,NO转化效率比NO2 的低;在250°C-450°C时,NOx转化率随温度升高而增大,450°C-600°C时NOx转化率随温度升高而减小,图象分析,开始二氧化氮转化率增大,反应正向进行,450°C左右达到最大,继续加热,二氧化氮转化率减小,反应是放热反应,说明平衡逆向进行,
故答案为:在250°C-450°C时,NOx转化率随温度升高而增大,反应正向进行,400°C左右达到最大,反应达到平衡,450°C-600°C时NOx转化率随温度升高而减小,反应是放热反应,升温平衡逆向进行,二氧化氮转化率减小;
②上述NO2和CH4反应中,该反应是放热反应,且该反应是气体体积增大的反应,提高NO2转化率的措施促使平衡正向进行;
A、催化剂只改变反应到达平衡的时间,不改变化学平衡状态,故A错误;
B、该反应是放热反应,所以降低温度,平衡向正反应方向移动,增大二氧化氮的转化率,故B正确;
C、分离出H2O(g),减少生成物的浓度,平衡向正反应方向移动,增大二氧化氮的转化率,故C正确;
D、该反应是气体体积增大的反应,增大压强,平衡向逆反应方向移动,二氧化氮的转化率降低,故D错误;
E、增加原催化剂的表面积改变反应速率,平衡不动,故E错误;
F、减小投料比[$\frac{n(N{O}_{2})}{n(C{H}_{4})}$],甲烷增多,二氧化氮减小,二氧化氮转化率提高,故F正确;
故答案为:BCF.
点评 本题考查了盖斯定律计算,原电池原理应用,化学平衡常数,平衡影响因素的分析判断,注意图象变化规律的理解应用,掌握平衡移动原理是关键,题目难度较大.

| A. | 某芳香烃的分子式为C10H14,它不能使溴水褪色,但可使酸性KMnO4溶液褪色,且分子结构中只有一个烷基,符合条件的烃有3种 | |
| B. | 按系统命名法,有机物  的命名为2,2,4,4,5-五甲基-3,3-二乙基己烷 的命名为2,2,4,4,5-五甲基-3,3-二乙基己烷 | |
| C. | 甲烷、甲醛、尿素都不存在同分异构体 | |
| D. | 某有机物含有C、H、O、N四种元素,其球棍模型为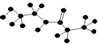 ,该有机物的结构简式为 ,该有机物的结构简式为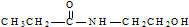 |
| A. | pH=a的醋酸溶液,稀释10倍后,其pH=b,则a=b-1 | |
| B. | 含等物质的量的NaHSO3和Na2SO3的溶液:2c(Na+)=3[c(HSO3-)+c(SO32-)+c(H2SO3)] | |
| C. | 0.1mol•L-1盐酸与0.2mol•L-1氨水等体积混合:c(NH3•H2O)>c(Cl-)>c(NH4+)>c(OH-) | |
| D. | 含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)=c(I-) |
| A. | 高温低压 | B. | 低温低压 | C. | 低温高压 | D. | 高温高压 |
| A. |  2-甲基丁烷 2-甲基丁烷 | B. |  间二甲苯 间二甲苯 | ||
| C. | CH3CH2CH2CH2OH 1-羟基丁烷 | D. |  2-甲基-2-丙烯 2-甲基-2-丙烯 |
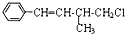
| A. | 该有机物的分子式为C11H13Cl | |
| B. | 该有机物能使溴水褪色 | |
| C. | 该有机物遇硝酸银溶液产生白色沉淀 | |
| D. | 该有机物在一定条件下,能发生消去反应或取代反应 |
| 选项 | 操作、现象 | 解释或结论 |
| A | 某溶液中先加稀HCl酸化,再加AgNO3,产生白色沉淀 | 原溶液有Cl-存在 |
| B | Cl2能使湿润的红布条褪色 | Cl2具有漂白性 |
| C | Na2SiO3溶液中通入CO2产生白色胶状沉淀 | H2CO3酸性大于H2SiO3 |
| D | 光照氯水有气泡产生 | 该气体一定是Cl2 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 甲可能是Pb304和PbO的混合物 | |
| B. | 整个反应过程中转移电子的总量为2.1mol | |
| C. | 若甲与浓盐酸充分反应,则需要消耗HCl的总量为2.8 mol | |
| D. | 甲中各物质的物质的量之比可能是n(PbO2):n(Pb304):n(PbO)=3:3:2 |