题目内容
3.有一处于平衡状态的反应A(g)+3B(g)?2C(g);△H<0,为了使平衡向生成C的方向移动,应选择的条件是( )| A. | 高温低压 | B. | 低温低压 | C. | 低温高压 | D. | 高温高压 |
分析 反应A(g)+3B(g)?2C(g),△H<0,正反应是气体物质的量减小的放热反应,低温高压平衡正向进行;
解答 解:反应A(g)+3B(g)?2C(g),△H<0,正反应是气体物质的量减小的放热反应,
A.高温平衡逆向进行,低压平衡向气体体积增大的方向进行,故A错误;
B.低温平衡向吸热反应方向进行,平衡正向进行,低压平衡逆向进行,故B错误;
C.低温平衡正向进行,高压平衡正向进行,平衡向生成C的方向移动,故C正确;
D.高温平衡逆向进行,高压平衡正向进行,故D错误;
故选C.
点评 本题考查化学平衡移动的影响因素等,难度中等,注意加入惰性气体对平衡的影响,恒温恒容平衡不移动,恒温恒压,体积增大,平衡向体积增大方向移动.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13. (1)已知:N2(g)+O2(g)═2NO(g)△H1=+180.5kJ/mol
(1)已知:N2(g)+O2(g)═2NO(g)△H1=+180.5kJ/mol
N2(g)+3H2(g)?2NH3(g)△H2=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g)△H3=-483.6kJ/mol
写出氨气催化氧化生成一氧化氮气体和水蒸气的热化学方程式4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905.0kJ/mol.
(2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对N2(g)+3H2(g)?2NH3(g)反应的影响.实验结果如图所示:(图中T表示温度,n表示物质的量)
①图象中T2和T1的关系是:T2低于T1(填“高于”“低于”“等于”“无法确定”)
②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是c(填字母).
(3)N2O5是一种新型硝化剂,其性质和制备受到人们的关注:一定温度下可发生下列反应:2N2O5(g)→4NO2(g)+O2(g)△H>0下表为反应在T1温度下的部分实验数据
①500s内NO2的平均生成速率为0.00592mol•L-1•s-1.
②该反应的化学平衡常数表达式为K=$\frac{{c}^{4}(N{O}_{2})•c({O}_{2})}{{c}^{2}({N}_{2}{O}_{5})}$.
 (1)已知:N2(g)+O2(g)═2NO(g)△H1=+180.5kJ/mol
(1)已知:N2(g)+O2(g)═2NO(g)△H1=+180.5kJ/molN2(g)+3H2(g)?2NH3(g)△H2=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g)△H3=-483.6kJ/mol
写出氨气催化氧化生成一氧化氮气体和水蒸气的热化学方程式4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905.0kJ/mol.
(2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对N2(g)+3H2(g)?2NH3(g)反应的影响.实验结果如图所示:(图中T表示温度,n表示物质的量)
①图象中T2和T1的关系是:T2低于T1(填“高于”“低于”“等于”“无法确定”)
②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是c(填字母).
(3)N2O5是一种新型硝化剂,其性质和制备受到人们的关注:一定温度下可发生下列反应:2N2O5(g)→4NO2(g)+O2(g)△H>0下表为反应在T1温度下的部分实验数据
| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol•L-1 | 5.00 | 3.52 | 2.48 |
②该反应的化学平衡常数表达式为K=$\frac{{c}^{4}(N{O}_{2})•c({O}_{2})}{{c}^{2}({N}_{2}{O}_{5})}$.
15.汽车尾气中的NOx是大气污染物之一,科学家们在尝试用更科学的方法将NOx转化成无毒物质,从而减少汽车尾气污染.
(1)压缩天然气(CNG)汽车的优点之一是利用催化技术能够将NOx转变成无毒的CO2和N2.
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2
③CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H3
则△H1、△H2、△H3三者关系式为△H3 =$\frac{△{H}_{1}+△{H}_{2}}{2}$.
(2)在恒压下,将CH4(g)和NO2(g)置于密闭容器中发生化学反应③,在不同温度、不同投料比时,NO2的平衡转化率见下表:
①写出该反应平衡常数的表达式K=$\frac{c({N}_{2}){c}^{2}({H}_{2}O)c(C{O}_{2})}{c(C{H}_{4}){c}^{2}(N{O}_{2})}$.
②若温度不变,提高[n(NO2):n(CH4)]投料比,则K将不变.(填“增大”、“减小”或“不变”)
③400K时,将投料比为1的NO2和CH4的混合气体共0.04mol,充入一装有催化剂的5L容器中,10分钟达到平衡,则NO2的化学反应速率为0.00024mol/L•min.
(3)连续自动监测氮氧化物(NOx)的仪器动态库仑仪的工作原理示意图如图1
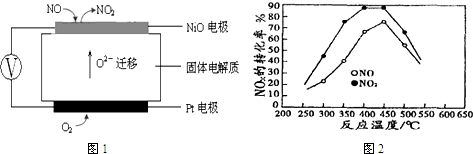
①NiO电极上NO发生的电极反应式NO-2e-+O2-═NO2.
②收集某汽车尾气经测量NOx的含量为1.12%(体积分数),若用甲烷将其完全转化为无害气体,处理1104L(标准状况下)该尾气需要甲烷30g,则尾气中n(NO):n(NO2)=1:1.
(4)在容积相同的两个密闭容器内(装有等量的某种催化剂)先各通入等量的CH4,然后再分别充入等量的NO和NO2.在不同温度下,同时分别发生②③两个反应:并在t秒时测定其中NOx转化率,绘得图象如图2所示:
①从图中可以得出的结论是:
结论一:相同温度下NO转化效率比NO2的低
结论二:在250℃-450℃时,NOx转化率随温度升高而增大,450℃-600℃时NOx转化率随温度升高而减小
结论二的原因是在250°C-450°C时,NOx转化率随温度升高而增大,反应正向进行,400°C左右达到最大,反应达到平衡,450°C-600°C时NOx转化率随温度升高而减小,反应是放热反应,升温平衡逆向进行,二氧化氮转化率减小.
②在上述NO2和CH4反应中,提高NO2转化率的措施有BCF.(填编号)
A.改用高效催化剂 B.降低温度 C.分离出H2O(g) D.增大压强
E.增加原催化剂的表面积 F.减小投料比[n(NO2):n(CH4)].
(1)压缩天然气(CNG)汽车的优点之一是利用催化技术能够将NOx转变成无毒的CO2和N2.
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2
③CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H3
则△H1、△H2、△H3三者关系式为△H3 =$\frac{△{H}_{1}+△{H}_{2}}{2}$.
(2)在恒压下,将CH4(g)和NO2(g)置于密闭容器中发生化学反应③,在不同温度、不同投料比时,NO2的平衡转化率见下表:
| 投料比[n(NO2):n(CH4)] | 400K | 500K | 600K |
| 1 | 60% | 43% | 28% |
| 2 | 45% | 33% | 20% |
②若温度不变,提高[n(NO2):n(CH4)]投料比,则K将不变.(填“增大”、“减小”或“不变”)
③400K时,将投料比为1的NO2和CH4的混合气体共0.04mol,充入一装有催化剂的5L容器中,10分钟达到平衡,则NO2的化学反应速率为0.00024mol/L•min.
(3)连续自动监测氮氧化物(NOx)的仪器动态库仑仪的工作原理示意图如图1

①NiO电极上NO发生的电极反应式NO-2e-+O2-═NO2.
②收集某汽车尾气经测量NOx的含量为1.12%(体积分数),若用甲烷将其完全转化为无害气体,处理1104L(标准状况下)该尾气需要甲烷30g,则尾气中n(NO):n(NO2)=1:1.
(4)在容积相同的两个密闭容器内(装有等量的某种催化剂)先各通入等量的CH4,然后再分别充入等量的NO和NO2.在不同温度下,同时分别发生②③两个反应:并在t秒时测定其中NOx转化率,绘得图象如图2所示:
①从图中可以得出的结论是:
结论一:相同温度下NO转化效率比NO2的低
结论二:在250℃-450℃时,NOx转化率随温度升高而增大,450℃-600℃时NOx转化率随温度升高而减小
结论二的原因是在250°C-450°C时,NOx转化率随温度升高而增大,反应正向进行,400°C左右达到最大,反应达到平衡,450°C-600°C时NOx转化率随温度升高而减小,反应是放热反应,升温平衡逆向进行,二氧化氮转化率减小.
②在上述NO2和CH4反应中,提高NO2转化率的措施有BCF.(填编号)
A.改用高效催化剂 B.降低温度 C.分离出H2O(g) D.增大压强
E.增加原催化剂的表面积 F.减小投料比[n(NO2):n(CH4)].
12.某学习小组共同学习乙醛的化学性质,以下是他们的学习过程,请填空:
(1)根据乙醛的结构对性质进行预测
(2)写出乙醛与氢气反应的方程式CH3CHO+H2$→_{△}^{催化剂}$CH3CH2OH
(3)设计实验验证乙醛的还原性,请填全表格.
根据上表及所学知识回答:
①乙醛被高锰酸钾溶液氧化为CH3COOH(填结构简式)
②写出乙醛发生银镜反应的方程式CH3CHO+2Ag(NH3)2OH$\stackrel{△}{→}$CH3COONH4+2Ag↓+3NH3+H2O
(4)某有机物只含C、H、O三种元素,该有机物对氢气的相对密度为15,完全燃烧 0.1mol该有机物生成4.4gCO2和1.8gH2O,该有机物的分子式为CH2O,若红外光谱显示该分子中有醛基,则3g该物质与足量的新制氢氧化铜反应,生成沉淀的质量为28.8g.
(1)根据乙醛的结构对性质进行预测
| 乙醛的结构特点 | 可能的化学性质 |
| 有C=O双键,不饱和 | 与H2发生加成反应,乙醛表现氧化性 |
CHO中C-H键极性较强 | CHO中C-H键被氧化,变为C-OH |
(3)设计实验验证乙醛的还原性,请填全表格.
| 实验 | 现象 | 结论 |
| 取适量乙醛溶液,滴加高锰酸钾酸性溶液 | 高锰酸钾溶液紫色变浅(褪去) | 乙醛能被高锰酸钾氧化 |
| 向新制银氨溶液中加入几滴乙醛溶液,水浴加热 | 试管壁上出现银镜(一层光亮如镜的银) | 乙醛将银氨溶液还原 |
| 向新制氢氧化铜悬浊液中加入适量乙醛溶液,加热 | 出现红色沉淀 | 乙醛被氢氧化铜氧化 |
①乙醛被高锰酸钾溶液氧化为CH3COOH(填结构简式)
②写出乙醛发生银镜反应的方程式CH3CHO+2Ag(NH3)2OH$\stackrel{△}{→}$CH3COONH4+2Ag↓+3NH3+H2O
(4)某有机物只含C、H、O三种元素,该有机物对氢气的相对密度为15,完全燃烧 0.1mol该有机物生成4.4gCO2和1.8gH2O,该有机物的分子式为CH2O,若红外光谱显示该分子中有醛基,则3g该物质与足量的新制氢氧化铜反应,生成沉淀的质量为28.8g.
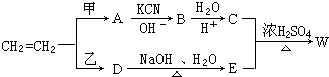
 .
. .
.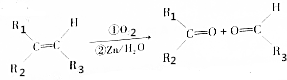
 和
和 各1mol.
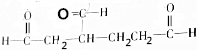
各1mol.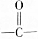 ),产物与烃分子中原子个数相等的元素有C、H.
),产物与烃分子中原子个数相等的元素有C、H. 可简写为
可简写为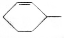 ,其中线表示化学键,线的端点、折点或交点表示碳原子,碳原子剩余的化合价用氢原子补足.写出A所有可能的结构简式:
,其中线表示化学键,线的端点、折点或交点表示碳原子,碳原子剩余的化合价用氢原子补足.写出A所有可能的结构简式: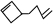 、
、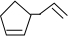 、
、 .
.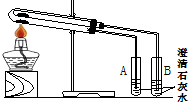 (1)为比较Na2CO3和NaHCO3的热稳定性,某同学设计了如下实验装置.实验时,先检查装置的气密性,再取少量Na2CO3粉末加在大试管的底部,另取少量NaHCO3粉末加在小试管底部.预热后在大试管底部加热.
(1)为比较Na2CO3和NaHCO3的热稳定性,某同学设计了如下实验装置.实验时,先检查装置的气密性,再取少量Na2CO3粉末加在大试管的底部,另取少量NaHCO3粉末加在小试管底部.预热后在大试管底部加热.