题目内容
室温下将下列溶液等体积混合后,所得溶液的pH一定大于7的是( )
| A、pH=4的盐酸和pH=10的氨水 |
| B、pH=4的醋酸溶液和pH=10的氢氧化钠溶液 |
| C、0.1mol?L-1的盐酸和0.1mol?L-1的氢氧化钠溶液 |
| D、0.1mol?L-1的硫酸和0.1mol?L-1的氢氧化钡溶液 |
考点:酸碱混合时的定性判断及有关ph的计算
专题:
分析:A、先计算出盐酸和氨水在氢离子、氢氧根离子浓度,再根据一水合氨为弱碱进行判断;
B、根据醋酸是弱电解质,醋酸的浓度大于溶液中氢离子的浓度判断;
C、盐酸和氢氧化钠都是强电解质,等体积混合恰好反应分析;
D、硫酸和氢氧化钡都是强电解质,等体积等浓度混合恰好中和分析.
B、根据醋酸是弱电解质,醋酸的浓度大于溶液中氢离子的浓度判断;
C、盐酸和氢氧化钠都是强电解质,等体积混合恰好反应分析;
D、硫酸和氢氧化钡都是强电解质,等体积等浓度混合恰好中和分析.
解答:
解:A、pH=4的盐酸中氢离子浓度为1×10-4mol/L,pH=l0的氨水中氢氧根离子浓度为1×10-4mol/L,由于一水合氨为弱碱,所以一水合氨的浓度大于1×10-4mol/L,反应后一水合氨过量,溶液显示碱性,溶液的pH大于7,故A正确;
B、pH=4的醋酸中氢离子浓度为1×10-4mol/L,pH=l0的氢氧化钠溶液中氢氧根离子浓度为1×10-4mol/L,由于醋酸是弱电解质,溶液中部分电离出氢离子,所以醋酸的浓度大于1×10-4mol/L,反应后醋酸过量,溶液显示酸性,pH<7,故B错误;
C、盐酸和氢氧化钠都是强电解质,等体积混合恰好反应,溶液pH=7,故C错误;
D、硫酸和氢氧化钡都是强电解质,等体积等浓度混合恰好中和,溶液pH=7,故D错误;
故选:A.
B、pH=4的醋酸中氢离子浓度为1×10-4mol/L,pH=l0的氢氧化钠溶液中氢氧根离子浓度为1×10-4mol/L,由于醋酸是弱电解质,溶液中部分电离出氢离子,所以醋酸的浓度大于1×10-4mol/L,反应后醋酸过量,溶液显示酸性,pH<7,故B错误;
C、盐酸和氢氧化钠都是强电解质,等体积混合恰好反应,溶液pH=7,故C错误;
D、硫酸和氢氧化钡都是强电解质,等体积等浓度混合恰好中和,溶液pH=7,故D错误;
故选:A.
点评:本题考查酸碱混合的定性判断和计算,题目难度不大,注意把握酸碱的强弱以及溶液物质的量浓度的大小比较,试题培养了学生的分析、理解能力.

练习册系列答案
相关题目
某混合溶液中可能含有下列离子中的若干种:K+、Na+、Fe2+、Fe3+、SO42-、NO2-、CO32- 现取三份20mL该溶液进行如下实验.根据上述实验,以下说法正确的是( )
①第一份加入足量稀盐酸,无任何气体产生;
②第二份加入足量NaOH,经搅拌,过滤,洗涤,灼烧,最后得到x g固体;
③第三份滴加0.1mol.L-1酸性KMnO4溶液,反应至终点,共消耗其体积为VmL;
④另用洁净的铂丝蘸取该混合溶液置于浅色火焰上灼烧,发现火焰呈现黄色.
①第一份加入足量稀盐酸,无任何气体产生;
②第二份加入足量NaOH,经搅拌,过滤,洗涤,灼烧,最后得到x g固体;
③第三份滴加0.1mol.L-1酸性KMnO4溶液,反应至终点,共消耗其体积为VmL;
④另用洁净的铂丝蘸取该混合溶液置于浅色火焰上灼烧,发现火焰呈现黄色.
| A、原混合溶液中只存在Na+、Fe3+、SO42-,不可能存在K+、CO32- |
| B、由实验①无法推断原混合溶液中是否含有SO42- |
| C、由实验①、②可判断原混合溶液中是否含有Fe3+ |
| D、由实验③可判断原混合溶液中存在Fe2+ |
下列有关说法正确的是 ( )
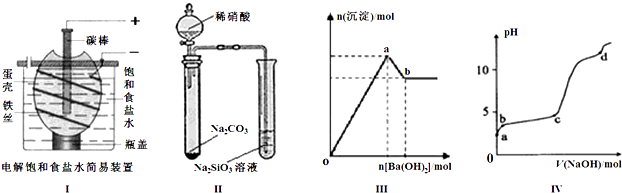

| A、按图Ⅰ装置电解一段时间后,往蛋壳外溶液中滴加几滴酚酞,溶液呈红色 |
| B、按图Ⅱ装置实验,可以证明酸性强弱关系为:硝酸>碳酸>硅酸 |
| C、图Ⅲ表示:向明矾溶液中逐滴加入Ba(OH)2溶液,生成沉淀的物质的量随Ba(OH)2加入量的变化曲线,则oa段发生的离子反应为: 2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ |
| D、图Ⅳ表示:室温时,将1mol?L-1 NaOH溶液逐滴滴入0.2mol?L-1 Al2(SO4)3溶液中,实验测得溶液pH随NaOH溶液体积变化曲线,则d点时Al(OH)3沉淀开始溶解 |
化合物A的分子式为C4H9NO2,A的同分异构体中属于氨基酸的有( )
| A、5种 | B、4种 | C、3种 | D、6种 |
下列叙述正确的是( )
| A、加入澄清石灰水除去NaHCO3溶液中混有的少量Na2CO3 |
| B、常温下,pH=1的水溶液中NO3-、I-、Na+,Fe3+可以大量共存 |
| C、硝酸铵溶液不能与镁反应生成氢气而氯化铵溶液能与镁反应生成氢气 |
| D、明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同 |

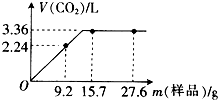 某同学用NaHCO3和KHCO3组成的混合物进行实验.现称取不同质量的该混合物溶于水后,分别滴入相同浓度的盐酸50mL,产生CO2气体的体积(标准状况下)与质量的关系曲线如图所示.
某同学用NaHCO3和KHCO3组成的混合物进行实验.现称取不同质量的该混合物溶于水后,分别滴入相同浓度的盐酸50mL,产生CO2气体的体积(标准状况下)与质量的关系曲线如图所示.