题目内容
下列有关说法正确的是 ( )
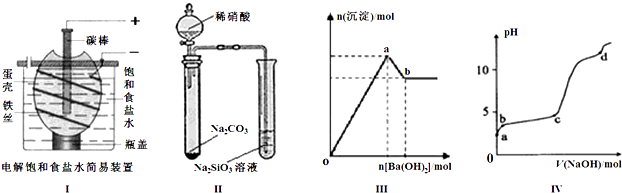

| A、按图Ⅰ装置电解一段时间后,往蛋壳外溶液中滴加几滴酚酞,溶液呈红色 |
| B、按图Ⅱ装置实验,可以证明酸性强弱关系为:硝酸>碳酸>硅酸 |
| C、图Ⅲ表示:向明矾溶液中逐滴加入Ba(OH)2溶液,生成沉淀的物质的量随Ba(OH)2加入量的变化曲线,则oa段发生的离子反应为: 2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ |
| D、图Ⅳ表示:室温时,将1mol?L-1 NaOH溶液逐滴滴入0.2mol?L-1 Al2(SO4)3溶液中,实验测得溶液pH随NaOH溶液体积变化曲线,则d点时Al(OH)3沉淀开始溶解 |
考点:原电池和电解池的工作原理,离子方程式的书写,酸碱混合时的定性判断及有关ph的计算
专题:
分析:A、蛋壳将氢氧根离子和钠离子隔离,起到隔膜作用,酚酞遇碱显红色;
B、浓硝酸与碳酸钠反应生成二氧化碳,但浓硝酸易挥发,硝酸、碳酸均可与硅酸钠溶液反应生成硅酸沉淀;
C、oa段生成的沉淀物质的量最多时,反应生成硫酸钡、氢氧化铝;
D、c点后pH发生突变,NaOH过量.
B、浓硝酸与碳酸钠反应生成二氧化碳,但浓硝酸易挥发,硝酸、碳酸均可与硅酸钠溶液反应生成硅酸沉淀;
C、oa段生成的沉淀物质的量最多时,反应生成硫酸钡、氢氧化铝;
D、c点后pH发生突变,NaOH过量.
解答:
解:A、铁电极是阴极,电极反应:2H++2e-═H2↑,碳棒做阳极,电极反应:2Cl-═Cl2↑+2e-,在阴极附近产生氢气和大量的氢氧根离子,酚酞遇碱显红色,故A正确;
B、浓硝酸与碳酸钠反应生成二氧化碳,但浓硝酸易挥发,硝酸、碳酸均可与硅酸钠溶液反应生成硅酸沉淀,则不能比较碳酸与硅酸的酸性,应排除硝酸的干扰,故B错误;
C、生成的沉淀物质的量最多时,反应生成硫酸钡、氢氧化铝,发生的离子反应为2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓,故C正确;
D、c点后pH发生突变,NaOH过量,Al(OH)3沉淀开始溶解,生成NaAlO2,碱性较强,而d点pH>10,NaOH远远过量,故D错误;
故选AC.
B、浓硝酸与碳酸钠反应生成二氧化碳,但浓硝酸易挥发,硝酸、碳酸均可与硅酸钠溶液反应生成硅酸沉淀,则不能比较碳酸与硅酸的酸性,应排除硝酸的干扰,故B错误;
C、生成的沉淀物质的量最多时,反应生成硫酸钡、氢氧化铝,发生的离子反应为2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓,故C正确;
D、c点后pH发生突变,NaOH过量,Al(OH)3沉淀开始溶解,生成NaAlO2,碱性较强,而d点pH>10,NaOH远远过量,故D错误;
故选AC.
点评:本题考查化学实验方案的评价,为高频考点,涉及浓硫酸的性质、酸性比较、氧化还原反应等,把握化学反应原理及实验装置中的反应为解答的关键,D项注意氢氧化铝的两性及图中c点pH突变为解答的关键,明确b→c段中铝离子过量,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列有关说法正确的是( )
| A、将NH3通入热的CuSO4溶液中能使Cu2+还原成Cu |
| B、室温下,饱和氯水中能大量存在C1-、Fe3+、NO3-、Na+、SO32- |
| C、浓度和体积相同的NaOH和CH3COOH相混合,溶液中c(Na+)>c(CH3COO-) |
| D、放电反应为H2+2NiO(OH)=2Ni(OH)2的电池,充电时,阴极上NiO(OH)被还原 |
下列物质与C5H10O2以任意比例混合,若总物质的量一定,充分燃烧消耗氧气的量相等且生成水的量也相等的是( )
| A、C5H12O3 |
| B、C4H10 |
| C、C6H10O4 |
| D、C5H10O |
室温下将下列溶液等体积混合后,所得溶液的pH一定大于7的是( )
| A、pH=4的盐酸和pH=10的氨水 |
| B、pH=4的醋酸溶液和pH=10的氢氧化钠溶液 |
| C、0.1mol?L-1的盐酸和0.1mol?L-1的氢氧化钠溶液 |
| D、0.1mol?L-1的硫酸和0.1mol?L-1的氢氧化钡溶液 |
下列与有机物的结构、性质相关的叙述错误的是( )
| A、分子式为C5H12的烃有三种可能的结构 |
| B、乙醇分子中含有羟基,可以和金属Na反应生成H2 |
| C、苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中相似的碳碳双键 |
| D、淀粉、蛋白质、油脂、葡萄糖在一定条件下均能发生水解反应 |


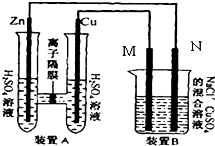 如图装置B中是浓度均为0.1mol/L的NaCl、CuSO4混合溶液,溶液体积为500ml,M、N均为石墨电极,当装置A中Zn棒质量减少6.5g时,N上质量增加
如图装置B中是浓度均为0.1mol/L的NaCl、CuSO4混合溶液,溶液体积为500ml,M、N均为石墨电极,当装置A中Zn棒质量减少6.5g时,N上质量增加