题目内容
2.在无色透明的酸性溶滚中,能大量共存的离子组是( )| A. | Na+、Al3+、NO3-、SO42- | B. | K+、Na+、CO32-、NO3- | ||
| C. | MnO4-、K+、SO42-、Na+ | D. | K+、Mg2+、SO32-、NO3- |
分析 酸性溶液中含大量的氢离子,根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应等,则离子大量共存,并结合离子的颜色来解答.
解答 解:A.酸溶液中该组离子之间不反应,可大量共存,且离子均为无色,故A正确;
B.酸溶液中不能大量存在CO32-,故B错误;
C.MnO4-为紫色,与无色不符,故C错误;
D.酸溶液中H+、SO32-、NO3-发生氧化还原反应,不能共存,故D错误;
故选A.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
12.有Fe2+﹑NO3-﹑Fe3+、NH4+﹑H2O 和H+六种微粒,分别属于一个氧化还原反应中的反应物和生成物,下列叙述错误的是( )
| A. | 氧化剂与还原剂的物质的量之比为8:1 | |
| B. | 还原产物为NH4+ | |
| C. | 若有1molNO3-参加还原反应,则转移3mol e- | |
| D. | 若把该反应设计为原电池,则负极反应为 Fe2+-e _=Fe3+ |
10.下列化学用语书写正确的是( )
| A. | S2-离子的结构示意图: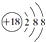 | B. | H2O2的电子式: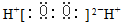 | ||
| C. | CO2的比例模型: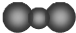 | D. | 有8个质子、10个中子的核素:188O |
17.实验室有一包白色固体,可能含有Na2CO3、NaCl和Na2SO3中的一种或多种.下列根据实验事实得出的结论正确的是( )
| A. | 称取18.0g固体,在空气中充分灼烧,质量增加1.6g;另取18.0g固体溶于足量稀盐酸,充分反应后,得到标况下气体3.36L(气体全部逸出),说明固体中一定含NaCl | |
| B. | 取一定量固体,溶解,向溶液中滴加适量AgNO3溶液,观察到有白色沉淀生成,说明原固体中一定含有NaCl | |
| C. | 取一定量固体,溶解,向溶液中滴加足量盐酸溶液,观察到有气体产生,将产生的气体通入澄清石灰水中变浑浊,说明原固体中一定含有Na2CO3 | |
| D. | 取一定量固体,溶解,向溶液中滴加适量Ca(NO3)2 溶液,观察到产生白色沉淀,说明原固体中一定含有Na2CO3 |
7.下列有关化学用语和概念的表达理解正确的是( )
| A. | 立体烷 和苯乙烯 和苯乙烯 互为同分异构体 互为同分异构体 | |
| B. | 1,3-丁二烯的键线式可表示为 | |
| C. | 二氟化氧分子电子式为  | |
| D. | H216O、D216O、H218O、D218O互为同素异形体 |
14.下列实验操作能实现符合题中要求的是( )
| A. | 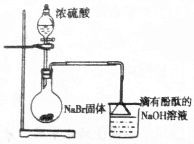 能证明制取HBr的现象使烧杯中红色褪去 | |
| B. | 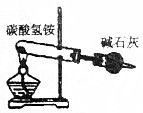 实验室可用此装置制取氨气 | |
| C. | 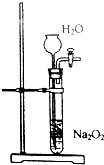 可以用于实验室制取氧气 | |
| D. | 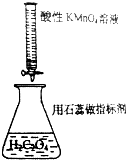 用KMnO4滴定H2C2O4 |
19.已知醋酸、醋酸根离子在溶液中存在下列平衡:
CH3COOH+H2O?CH3COO-+H3O+K1=1.75×10-5 mol•L-1
CH3COO-+H2O?CH3COOH+OH-K2=5.71×10-10 mol•L-1
现将 50mL 0.2mol•L-1 醋酸与 50mL 0.2mol•L-1 醋酸钠溶液混合制得溶液甲,下列叙 述正确的是( )
CH3COOH+H2O?CH3COO-+H3O+K1=1.75×10-5 mol•L-1
CH3COO-+H2O?CH3COOH+OH-K2=5.71×10-10 mol•L-1
现将 50mL 0.2mol•L-1 醋酸与 50mL 0.2mol•L-1 醋酸钠溶液混合制得溶液甲,下列叙 述正确的是( )
| A. | 溶液甲的 pH>7 | |
| B. | 对溶液甲进行微热,K1、K2 同时增大 | |
| C. | 若在溶液甲中加入少量的 NaOH 溶液,溶液的 pH 明显增大 | |
| D. | 若在溶液甲中加入 5 mL 0.1 mol•L-1 的盐酸,则溶液中醋酸的 K1 会变大 |