题目内容
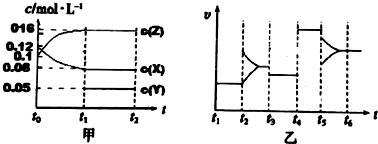
19.已知醋酸、醋酸根离子在溶液中存在下列平衡:CH3COOH+H2O?CH3COO-+H3O+K1=1.75×10-5 mol•L-1
CH3COO-+H2O?CH3COOH+OH-K2=5.71×10-10 mol•L-1
现将 50mL 0.2mol•L-1 醋酸与 50mL 0.2mol•L-1 醋酸钠溶液混合制得溶液甲,下列叙 述正确的是( )
| A. | 溶液甲的 pH>7 | |
| B. | 对溶液甲进行微热,K1、K2 同时增大 | |
| C. | 若在溶液甲中加入少量的 NaOH 溶液,溶液的 pH 明显增大 | |
| D. | 若在溶液甲中加入 5 mL 0.1 mol•L-1 的盐酸,则溶液中醋酸的 K1 会变大 |
分析 A.由K的关系可知,醋酸和醋酸钠的混合溶液中,电离大于水解,溶液显酸性;
B.电离、水解均为吸热反应;
C.醋酸与醋酸钠为缓冲溶液;
D.加入盐酸,酸性增强,但醋酸的电离常数只与温度有关.
解答 解:A.由K的关系可知,醋酸和醋酸钠的混合溶液中,电离大于水解,溶液显酸性,pH<7,故A错误;
B.电离、水解均为吸热反应,则对甲进行微热,K1、K2同时增大,故B正确;
C.醋酸与醋酸钠为缓冲溶液,则若在甲中加入少量的NaOH溶液,溶液的pH几乎不变,故C错误;
D.加入盐酸,酸性增强,但醋酸的电离常数只与温度有关,则溶液中醋酸的K1不变,故D错误;
故选B.
点评 本题考查弱电解质的电离及盐类水解,明确电离与水解的程度及K的影响因素即可解答,题目难度中等,侧重于考查学生的分析能力和对基础知识的应用能力.

练习册系列答案
相关题目
2.在无色透明的酸性溶滚中,能大量共存的离子组是( )
| A. | Na+、Al3+、NO3-、SO42- | B. | K+、Na+、CO32-、NO3- | ||
| C. | MnO4-、K+、SO42-、Na+ | D. | K+、Mg2+、SO32-、NO3- |
4.下列有关物质性质和用途的描述,正确的是( )
| A. | 氢氟酸具有强酸性,可用于雕刻玻璃 | |
| B. | 浓硫酸具有吸水性,可用浓硫酸干燥SO2、H2S、NO2等气体 | |
| C. | 常温下,铝比铁耐腐蚀,可用铝锅长期盛放酸性食物 | |
| D. | 氨气与氯气能反应生成氯化铵,可用浓氨水检验输送氯气的管道是否有泄漏 |
11.一份由氧化镁、氧化铝、二氧化硅和氧化铁组成的混合物粉末,先将其溶于过量的盐酸,过滤后,得到沉淀X和滤液Y.下列叙述正确的是( )
| A. | 该混合粉末从组成看,其成分皆是碱性氧化物 | |
| B. | 溶液Y 中2n(Mg2+)<n(Cl-)<3n(Fe3+) | |
| C. | 沉淀X的成分为二氧化硅 | |
| D. | 在溶液Y 中加入过量的氨水,过滤得到的沉淀的成分是氢氧化铁和氢氧化镁 |
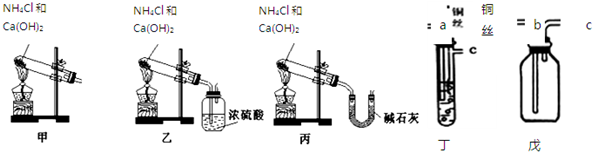
 2NH3.
2NH3.
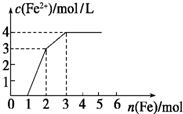 向含Fe(NO3)3、Cu(NO3)2、HNO3的稀溶液中逐渐加入铁粉,c(Fe2+)的变化如图所示.
向含Fe(NO3)3、Cu(NO3)2、HNO3的稀溶液中逐渐加入铁粉,c(Fe2+)的变化如图所示.