题目内容
12.有Fe2+﹑NO3-﹑Fe3+、NH4+﹑H2O 和H+六种微粒,分别属于一个氧化还原反应中的反应物和生成物,下列叙述错误的是( )| A. | 氧化剂与还原剂的物质的量之比为8:1 | |
| B. | 还原产物为NH4+ | |
| C. | 若有1molNO3-参加还原反应,则转移3mol e- | |
| D. | 若把该反应设计为原电池,则负极反应为 Fe2+-e _=Fe3+ |
分析 Fe2+具有还原性,NO3-在酸性条件下具有强氧化性,由题意可以确定,铁元素的化合价升高,N元素的化合价降低,则发生反应8Fe2++NO3-+10H+=8Fe3++NH4++H2O.
A、该反应中氧化剂是NO3-,还原剂是Fe2+,结合方程式判断氧化剂与还原剂的物质的量之比.
B、氧化剂通过还原反应生成的产物为还原产物.反应中N元素的化合价由NO3-中+5价降低为NH4+中-3价.
C、反应中N元素的化合价由NO3-中+5价降低为NH4+中-3价,据此计算有lmolNO3- 发生还原反应,转移电子数.
D、原电池负极发生氧化反应,Fe2+在负极放电生成Fe3+.
解答 解:Fe2+具有还原性,NO3-在酸性条件下具有强氧化性,由题意可以确定,铁元素的化合价升高,N元素的化合价降低,则发生反应8Fe2++NO3-+10H+=8Fe3++NH4++H2O.
A、由方程式可知该反应中氧化剂(NO3-)与还原剂(Fe2+)物质的量之比为1:8,故A错误;
B、反应中N元素的化合价由NO3-中+5价降低为NH4+中-3价,NH4+是还原产物,故B正确;
C、反应中N元素的化合价由NO3-中+5价降低为NH4+中-3价,所以有lmolNO3- 发生还原反应,转移电子数为1mol×[5-(-3)]=8mol,故C错误;
D、原电池负极发生氧化反应,Fe2+在负极放电生成Fe3+,若把该反应设计成原电池,负极反应为Fe2+-e-=Fe3+,故D正确.
故选:AC.
点评 本题考查氧化还原反应、原电池等,难度中等,根据反应物和生成物结合物质的性质书写该反应的离子方程式是解答关键,侧重于考查学生的分析能力和计算能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2.一种熔融碳酸盐燃料电池原理示意如图.下列有关该电池的说法正确的是( )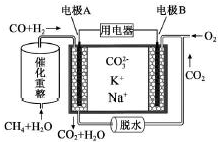

| A. | 正极产物为CO2 | |
| B. | 负极电极反应式为CO-2e-+CO32-═2CO2 | |
| C. | 电池工作时,CO32-向电极A移动 | |
| D. | 电池总反应式为CO+H2+O2═2CO2+H2O |
20.比较下列物质的稳定性,正确的是( )
| A. | Na2O>Na2O2 | B. | Na2CO3>NaHCO3>H2CO3 | ||
| C. | Na2SO4•10H2O>Na2CO3•10H2O | D. | NaClO>NaCl>NaF |
7.下列表示对应化学反应的离子方程式正确的是( )
| A. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag | |
| B. | Ba(OH)2溶液中滴加过量的NaHCO3溶液:Ba2++2OH-+2HCO3-=BaCO3↓+CO32-+2H2O | |
| C. | 碳酸钙溶于稀醋酸中:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 澄清的石灰水中通过量的CO2:Ca(OH)2+CO2=CaCO3↓+2H2O |
17.下列化学反应的离子方程式书写正确的是( )
| A. | 用小苏打治疗胃酸过多:HCO3-+H+═CO2↑+H2O | |
| B. | Ca(HCO3)2溶液与过量NaOH溶液反应:HCO3-+OH-═CO32-+H2O | |
| C. | 利用腐蚀法制作印刷线路板:Fe3++Cu═Fe2++Cu2+ | |
| D. | 钠与水反应:Na+H2O═Na++OH-+H2↑ |
4.下列关于物质的量浓度的表述中正确的是( )
| A. | 0.3 mol/L Na2SO4溶液中含有Na+和SO42-总物质的量为0.9mol | |
| B. | 当1L水吸收22.4LNH3时所得氨水的浓度不是1 mol/L,只有当22.4L NH3溶于水制得1L氨水时,其浓度才是1 mol/L | |
| C. | 10℃时0.5 mol/L的稀盐酸100mL,蒸发掉5g水,冷却到10℃时,其体积小于100mL,它的物质的量浓度大于0.5 mol/L | |
| D. | 10℃时0.5 mol/L的KCl饱和溶液100mL,蒸发掉5g水,冷却到10℃时,其体积小于100 mL,它的物质的量浓度仍为0.5 mol/L |
1.下列化合物的分子中,所有原子都处于同一平面的是( )
| A. | 乙酸 | B. | 甲苯 | C. | 甲醇 | D. | 四氟乙烯 |
2.在无色透明的酸性溶滚中,能大量共存的离子组是( )
| A. | Na+、Al3+、NO3-、SO42- | B. | K+、Na+、CO32-、NO3- | ||
| C. | MnO4-、K+、SO42-、Na+ | D. | K+、Mg2+、SO32-、NO3- |
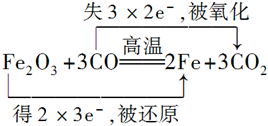 .
.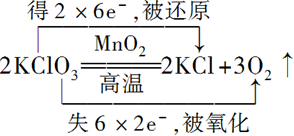 .
. .
.