题目内容
8.设NA为阿伏加德罗常数的数值,下列说法正确的是( )| A. | 标准状况下,2.24L苯含有的分子数为0.1NA | |
| B. | 常温常压下,18g H2O含有10nA个电子 | |
| C. | 1L1mol•L-1的NH4Cl溶液中有nA个NH4+ | |
| D. | 一定条件下,向密闭容器中投入3mol H2和1mol N2充分反应后可得到NH3分子数为2NA |
分析 A.标准状况下,苯的状态不是气体,不能使用标况下的气体摩尔体积计算苯的物质的量;
B.18g水的物质的量为1mol,1mol水中含有2mol氢原子;
C.NH4+发生水解;
D.氮气与氢气反应是可逆反应.
解答 解:A.标况下,苯不是气体,题中条件无法计算2.24L苯的物质的量,故A错误;
B.18g水的物质的量为1mol,含有2mol氢原子,含有2NA个氢原子,故B正确;
C.由于NH4+发生水解,1L1mol•L-1NH4Cl溶液中NH4+数目小于NA,故C错误;
D.氮气与氢气反应是可逆反应,不能进行到底,故D错误.
故选B.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清转移电子数,明确标准状况下苯不是气体;试题有利于培养学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
相关题目
18.某溶液中仅含Na+、H+、OH-、CH3COO-四种离子,下列说法错误的是( )
| A. | 溶液中四种粒子之间可能满足:c(Na+)>c(OH-)>c(H+)>c(CH3COO-) | |
| B. | 若溶液中部分粒子间满足:c(CH3COO-)=c(Na+),则该溶液一定呈中性 | |
| C. | 若溶液中溶质仅为CH3COONa,则粒子间一定满足:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 若溶液中的溶质为CH3COONa和CH3COOH,则溶液中粒子间可能满足:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
19.(1)除去下列物质中所含少量杂质,填写所选用的试剂和分离方法
(2)某芳香族化合物的分子式为C7H8O,根据下列实验现象写出相应的结构简式:(要求:每小题只需给出一个答案即可.)
①不能与金属钠反应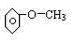 .
.
②能与钠反应,但遇FeCl3不显色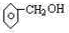 .
.
③能与钠反应且遇FeCl3显紫色 .
.
| 混合物 (括号内为少量杂质) | 试剂 (足量) | 分离方法 | |
| A | 苯(苯酚) | ||
| B | 乙酸乙酯(乙酸) | ||
| C | 乙醇(水) |
①不能与金属钠反应
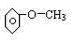 .
.②能与钠反应,但遇FeCl3不显色
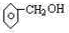 .
.③能与钠反应且遇FeCl3显紫色
 .
.
3.某化学活动小组制备一定量的氢气,下列方法能达到目的是( )
| A. | Cu和稀硝酸 | B. | Zn和浓硝酸 | ||
| C. | Fe和浓硫酸 | D. | Al和氢氧化钠溶液 |
13.对于0.1mol•L-1(NH4)2SO4溶液,不正确的是( )
| A. | c(NH4+)>c(SO42-) | B. | c(NH4+)+c(NH3•H2O)=2c(SO42-) | ||
| C. | c(NH4+)+c(H+)=c(SO42-)+c(OH-) | D. | 加入少量NaOH固体,c(NH4+)增大 |
17.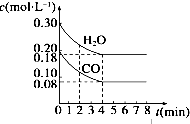 800℃时在体积为1L恒容密闭容器中,通入一定量的CO和H2O(g),发生反应:CO(g)+H2O(g)?H2(g)+CO2(g) CO和H2O(g)浓度变化如图所示.下列说法正确的是( )
800℃时在体积为1L恒容密闭容器中,通入一定量的CO和H2O(g),发生反应:CO(g)+H2O(g)?H2(g)+CO2(g) CO和H2O(g)浓度变化如图所示.下列说法正确的是( )
 800℃时在体积为1L恒容密闭容器中,通入一定量的CO和H2O(g),发生反应:CO(g)+H2O(g)?H2(g)+CO2(g) CO和H2O(g)浓度变化如图所示.下列说法正确的是( )
800℃时在体积为1L恒容密闭容器中,通入一定量的CO和H2O(g),发生反应:CO(g)+H2O(g)?H2(g)+CO2(g) CO和H2O(g)浓度变化如图所示.下列说法正确的是( )| A. | 容器中气体的压强不再改变则反应达到平衡 | |
| B. | 4 min后升高温度,CO和H2O(g)浓度也升高,则△H>0 | |
| C. | 800℃时只改变CO和H2O(g)起始投料,分别达平衡,CO的转化率与H2O(g)的转化率之和不变 | |
| D. | 若起始充入0.30 mol CO、0.10 mol H2O、0.20 mol CO2和20mol H2,则反应将向正反应方向进行 |
18.化学中常借助曲线图来表示某种变化过程,如①平衡移动过程、②中和滴定过程、③沉淀的生成和溶解、④固体物质的溶解度变化过程等,下列曲线图中从左到右依次表示上述过程中的( )


| A. | ①②③④ | B. | ②③①④ | C. | ④③②① | D. | ②①③④ |
 .
.
 .
. .
.