题目内容
2.氯气用于自来水的杀菌消毒,但在消毒时会产生一些负面影响,因此人们开始研究一些新型自来水消毒剂.某学习小组查阅资料发现NCl3可作为杀菌消毒剂,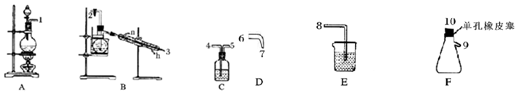
该小组利用图所示的装置制备NCl3,并探究NCl3的漂白性.
NCl3的相关性质如下:
| 物理性质 | 制备原理 | 化学性质 |
| 黄色油状液体,熔点为-40℃,沸点为71℃,不溶于冷水,易溶于有机溶剂,密度为1.65g/mL | Cl2与NH4Cl水溶液在低温下反应 | 95℃爆炸,热水中能与水反应 |
(1)根据实验目的,接口连接的顺序为1→4→5→2→3→6→7→10→9→8.
(2)C装置作用是除去氯气中氯化氢气体.
(3)B装置中发生反应的化学方程式为3Cl2+NH4Cl═NCl3+4HCl,当B装置蒸馏烧瓶中出现较多油状液体后,关闭接口2处的活塞,控制水浴加热的温度为71~95℃.
(4)当F装置的锥形瓶内有较多黄色油状液体出现时,用干燥、洁净的玻璃棒蘸取该液体滴到干燥的红色石蕊试纸上,试纸不褪色;若取该液体滴入50-60℃热水中,片刻后取该热水再滴到干燥的红色石蕊试纸上,试纸先变蓝后褪色,写出有关化学反应方程式并解释实验现象:NCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$3HClO+NH3;NCl3本身无漂白性;NCl3在热水中水解生成NH3•H2O使红色石蕊试纸变蓝,生成的HClO又使其漂白褪色.
分析 (1)A装置制备氯气,制备的氯气中含有HCl、水蒸气,用饱和食盐水除去HCl,B装置中Cl2与NH4Cl水溶液在低温下反应得到NCl3,加热蒸馏,再冷凝收集NCl3,最后用氢氧化钠溶液吸收尾气,防止污染空气,据此排序;
(2)氯气、氯化氢都能引起空气污染,不能直接排放,应进行尾气处理,依据氯气性质选择合适的除杂剂;
(3)B装置中Cl2与NH4Cl水溶液在低温下反应得到NCl3,还生成HCl;加热蒸馏出NCl3,NCl3的沸点为71℃,在95℃爆炸,可知控制蒸馏温度范围;
(4)NCl3本身无漂白性,与水反应生成次氯酸和氨气,氨气与水反应生成一水合氨,一水合氨电离出氢氧根离子,溶液显碱性,使红色石蕊试纸变蓝,生成的HClO又使其漂白褪色,据此解答.
解答 解:(1)A装置制备氯气,制备的氯气中含有HCl、水蒸气,用饱和食盐水除去HCl,B装置中Cl2与NH4Cl水溶液在低温下反应得到NCl3,加热蒸馏,再冷凝收集NCl3,最后用氢氧化钠溶液吸收尾气,防止污染空气,故仪器接口连接的顺序为:1、4、5、2、3、6、7、10、9、8,
故答案为:4、5 10、9、8;
(2)氯气中含有氯化氢通过饱和食盐水除去,
故答案为:除去氯气中氯化氢气体;
(3)B装置中Cl2与NH4Cl水溶液在低温下反应得到NCl3,还生成HCl,反应方程式为:3Cl2+NH4Cl═NCl3+4HCl;加热蒸馏出NCl3,NCl3的沸点为71℃,在95℃爆炸,所以应控制蒸馏温度为71~95℃,
故答案为:3Cl2+NH4Cl═NCl3+4HCl;71~95℃;
(4)NCl3本身无漂白性,与水反应生成次氯酸和氨气,化学方程式:NCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$3HClO+NH3;,氨气与水反应生成一水合氨,一水合氨电离出氢氧根离子,溶液显碱性,使红色石蕊试纸变蓝,生成的HClO又使其漂白褪色;
故答案为:NCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$3HClO+NH3;NCl3本身无漂白性;NCl3在热水中水解生成NH3•H2O使红色石蕊试纸变蓝,生成的HClO又使其漂白褪色.
点评 本题考查物质制备与性质探究实验,关键是理解实验原理和各装置作用,侧重考查学生实验能力、分析能力,题目难度中等.

| A. | 升高温度,H2S浓度增加,表明该反应的△H>0 | |
| B. | 随着反应的进行,混合气体的密度逐渐减小 | |
| C. | 反应前H2S物质的量为7mol | |
| D. | CO的平衡转化率为80% |
| A | B | ||||||
| D | E | F | |||||
| C | G | H |
(2)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其结构式为
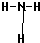 ,F的氢化物比同主族相邻元素的氢化物的沸点高,其原因是H2O分子间存在氢键.
,F的氢化物比同主族相邻元素的氢化物的沸点高,其原因是H2O分子间存在氢键.(3)现有另一种元素X,其原子获得一个电子所释放出的能量是所有短周期元素中最大的,则X元素在周期表中的位置是第2周期第VIIA族.
(4)“神舟”载人飞船内需要有一种由上表提供的某两种元素组成的化合物来吸收航天员呼出的CO2并放出O2,该物质的电子式为
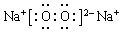 .
. ①1:3 ②2:3 ③1:7 ④2:7 ⑤任意比.
| A. | ②④ | B. | 只有① | C. | ②④ | D. | ①③ |
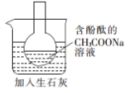
| A. |  用图 1所示装置除去乙烯中少量 SO2 气体 | |
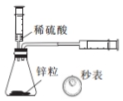
| B. |  用图 装置量取 20.00 mL 0.10 mol•L-1硫酸 | |
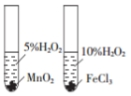
| C. |  用图 装置能验证 HCl 气体在水中的溶解性 | |
| D. |  用图 装置从碘的 CCl4溶液中分离出碘 |
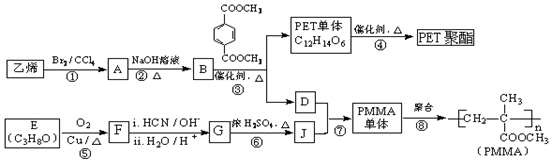
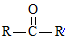 $→_{ii.H_{2}O/H+}^{i.HCN/OH-}$
$→_{ii.H_{2}O/H+}^{i.HCN/OH-}$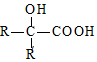 (R、R′代表烃基)
(R、R′代表烃基) .
. .
.