题目内容
7.表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素.| A | B | ||||||
| D | E | F | |||||
| C | G | H |
(2)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其结构式为
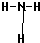 ,F的氢化物比同主族相邻元素的氢化物的沸点高,其原因是H2O分子间存在氢键.
,F的氢化物比同主族相邻元素的氢化物的沸点高,其原因是H2O分子间存在氢键.(3)现有另一种元素X,其原子获得一个电子所释放出的能量是所有短周期元素中最大的,则X元素在周期表中的位置是第2周期第VIIA族.
(4)“神舟”载人飞船内需要有一种由上表提供的某两种元素组成的化合物来吸收航天员呼出的CO2并放出O2,该物质的电子式为
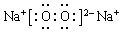 .
.
分析 由图可知,A为H,B为He,C为Na,D为C,E为N,F为O,G为Si,H为Cl,
(1)电子层越多,原子半径越大,同周期从左向右原子半径减小;非金属性越强,最高氧化物对应水化物的酸性越强;
(2)A与E可形成一种极易溶于水的气态化合物为氨气,水分子间含氢键,沸点高;
(3)X原子获得一个电子所释放出的能量是所有短周期元素中最大的,则X的非金属性最强;
(4)化合物来吸收航天员呼出的CO2并放出O2,该物质为过氧化钠.
解答 解:由元素在短周期中的位置可知,A为H,B为He,C为Na,D为C,E为N,F为O,G为Si,H为Cl,
(1)C、D、G三种元素的原子半径由大到小的顺序是Na>Si>C;H、G的最高氧化物对应水化物的酸性由强至弱的顺序是HClO4>H2SiO3(或H4SiO4),
故答案为:Na>Si>C;HClO4>H2SiO3(或H4SiO4);
(2)A与E可形成一种极易溶于水的气态化合物为氨气,氨气分子的结构式为 ,F的氢化物比同主族相邻元素的氢化物的沸点高,其原因是H2O分子间存在氢键,故答案为:
,F的氢化物比同主族相邻元素的氢化物的沸点高,其原因是H2O分子间存在氢键,故答案为: ;H2O分子间存在氢键;
;H2O分子间存在氢键;
(3)X元素为F,在周期表中的位置是第2周期第VIIA族,故答案为:第2周期第VIIA族;
(4)化合物来吸收航天员呼出的CO2并放出O2,该物质为过氧化钠,其电子式为 ,故答案为:
,故答案为: .
.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识应用,题目难度不大.

练习册系列答案
相关题目
18.下列实验操作中错误的是( )
| A. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 蒸馏中,冷却水应从冷凝管的下口通入,上口流出 | |
| D. | 过滤操作时,漏斗颈下端不能紧靠烧杯内壁 |
15. 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①碱式滴定管用蒸馏水洗净后,用待测溶液润洗2~3次后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中;
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至指示剂恰好变色,且半分钟不变化,测得所耗盐酸的体积为V1mL;
④重复以上过程,但滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL.
(1)该滴定实验终点的现象时当最后一滴标准液滴下,锥形瓶中溶液的颜色由红变无色,半分钟内颜色不再变化.
(2)滴定时边滴边摇动形瓶,眼睛应注视锥形瓶内溶液颜色的变化;
(3)该小组在步骤①中的错误是待测溶液润洗锥形瓶,由此造成的测定结果偏高(填偏高、偏低或无影响);
(4)步骤②缺少的操作是用盐酸标准液润洗酸式滴定管;
(5)如图,是某次滴定滴定管中的液面,其读数为27.20mL
(6)根据下列数据:
请选用合理的数据计算待测烧碱溶液的浓度为0.0800 mol/L
(7)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是D;
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,滴定结束时俯视读数.
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①碱式滴定管用蒸馏水洗净后,用待测溶液润洗2~3次后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中;
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至指示剂恰好变色,且半分钟不变化,测得所耗盐酸的体积为V1mL;
④重复以上过程,但滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL.
(1)该滴定实验终点的现象时当最后一滴标准液滴下,锥形瓶中溶液的颜色由红变无色,半分钟内颜色不再变化.
(2)滴定时边滴边摇动形瓶,眼睛应注视锥形瓶内溶液颜色的变化;
(3)该小组在步骤①中的错误是待测溶液润洗锥形瓶,由此造成的测定结果偏高(填偏高、偏低或无影响);
(4)步骤②缺少的操作是用盐酸标准液润洗酸式滴定管;
(5)如图,是某次滴定滴定管中的液面,其读数为27.20mL
(6)根据下列数据:
| 滴定次数 | 待测液体(mL) | 标准盐酸体积(mL) | |
| 滴定前读(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.10 |
| 第三次 | 25.00 | 0.80 | 23.10 |
(7)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是D;
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,滴定结束时俯视读数.
2.氯气用于自来水的杀菌消毒,但在消毒时会产生一些负面影响,因此人们开始研究一些新型自来水消毒剂.某学习小组查阅资料发现NCl3可作为杀菌消毒剂,
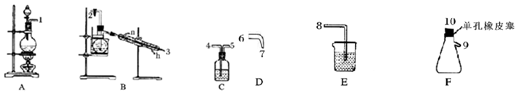
该小组利用图所示的装置制备NCl3,并探究NCl3的漂白性.
NCl3的相关性质如下:
回答下列问题:
(1)根据实验目的,接口连接的顺序为1→4→5→2→3→6→7→10→9→8.
(2)C装置作用是除去氯气中氯化氢气体.
(3)B装置中发生反应的化学方程式为3Cl2+NH4Cl═NCl3+4HCl,当B装置蒸馏烧瓶中出现较多油状液体后,关闭接口2处的活塞,控制水浴加热的温度为71~95℃.
(4)当F装置的锥形瓶内有较多黄色油状液体出现时,用干燥、洁净的玻璃棒蘸取该液体滴到干燥的红色石蕊试纸上,试纸不褪色;若取该液体滴入50-60℃热水中,片刻后取该热水再滴到干燥的红色石蕊试纸上,试纸先变蓝后褪色,写出有关化学反应方程式并解释实验现象:NCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$3HClO+NH3;NCl3本身无漂白性;NCl3在热水中水解生成NH3•H2O使红色石蕊试纸变蓝,生成的HClO又使其漂白褪色.

该小组利用图所示的装置制备NCl3,并探究NCl3的漂白性.
NCl3的相关性质如下:
| 物理性质 | 制备原理 | 化学性质 |
| 黄色油状液体,熔点为-40℃,沸点为71℃,不溶于冷水,易溶于有机溶剂,密度为1.65g/mL | Cl2与NH4Cl水溶液在低温下反应 | 95℃爆炸,热水中能与水反应 |
(1)根据实验目的,接口连接的顺序为1→4→5→2→3→6→7→10→9→8.
(2)C装置作用是除去氯气中氯化氢气体.
(3)B装置中发生反应的化学方程式为3Cl2+NH4Cl═NCl3+4HCl,当B装置蒸馏烧瓶中出现较多油状液体后,关闭接口2处的活塞,控制水浴加热的温度为71~95℃.
(4)当F装置的锥形瓶内有较多黄色油状液体出现时,用干燥、洁净的玻璃棒蘸取该液体滴到干燥的红色石蕊试纸上,试纸不褪色;若取该液体滴入50-60℃热水中,片刻后取该热水再滴到干燥的红色石蕊试纸上,试纸先变蓝后褪色,写出有关化学反应方程式并解释实验现象:NCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$3HClO+NH3;NCl3本身无漂白性;NCl3在热水中水解生成NH3•H2O使红色石蕊试纸变蓝,生成的HClO又使其漂白褪色.
19.已知X2、Y2、Z2、W2四种物质的氧化能力依次减弱的顺序为W2、Z2、X2、Y2,下列氧化还原反应能发生的是( )
| A. | 2W-+Z2═2Z-+W2 | B. | 2X-+Z2═2Z-+X2 | C. | 2Y-+W2═2W-+Y2 | D. | 2Z-+X2═2X-+Z2 |
17.铜及其化合物在工农业生产及日常生活中应用非常广泛.回答下列问题:
(1)纳米级Cu2O由于具有优良的催化性能而受到关注,制取Cu2O的两种方法如表所示.
①方法I中还原剂与氧化剂的物质的量之比为1:4.
②方法II发生反应的化学方程式为4Cu(OH)2+N2H4=Cu2O+N2↑+6H2O.
(2)氢化亚铜是一种红色同体,可由下列反应制备:4CuSO4+3H3PO2+6H2O=4CuH↓+4H2SO4+3H3PO4
该反应中每转移3mol电子,生成CuH的物质的量为1mol.
(3)氯化铜溶液中各种含铜微粒的分布分数(平衡时某微粒的浓度占各微粒浓度之和的分数)与c(C1-)之间的关系如图所示.
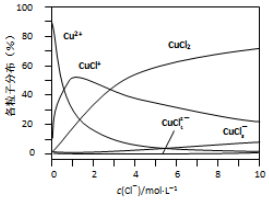
①当c(C1-)=9mol/L时,溶液中3种主要含铜微粒浓度的大小关系为c(CuCl2)>c(CuCl+)>c(CuCl3-).
②在c(C1-)=l mol/L的氯化铜溶液中,加人AgNO3溶液,CuCl+转化为Cu2+的离子方程式为CuCl++Ag+=Cu2++AgCl↓.
(4)已知:Cu(OH)2是二元弱碱,25℃时Ksp=2.0×10-20.则此温度下在铜盐溶液中Cu2+发生水解反应的平衡常数为5×10-9.
(1)纳米级Cu2O由于具有优良的催化性能而受到关注,制取Cu2O的两种方法如表所示.
| 方法I | 用炭粉在高温条件下还原CuO生成Cu2O和CO2 |
| 方法II | 用肼(N2H4)还原新制Cu(OH)2 |
②方法II发生反应的化学方程式为4Cu(OH)2+N2H4=Cu2O+N2↑+6H2O.
(2)氢化亚铜是一种红色同体,可由下列反应制备:4CuSO4+3H3PO2+6H2O=4CuH↓+4H2SO4+3H3PO4
该反应中每转移3mol电子,生成CuH的物质的量为1mol.
(3)氯化铜溶液中各种含铜微粒的分布分数(平衡时某微粒的浓度占各微粒浓度之和的分数)与c(C1-)之间的关系如图所示.

①当c(C1-)=9mol/L时,溶液中3种主要含铜微粒浓度的大小关系为c(CuCl2)>c(CuCl+)>c(CuCl3-).
②在c(C1-)=l mol/L的氯化铜溶液中,加人AgNO3溶液,CuCl+转化为Cu2+的离子方程式为CuCl++Ag+=Cu2++AgCl↓.
(4)已知:Cu(OH)2是二元弱碱,25℃时Ksp=2.0×10-20.则此温度下在铜盐溶液中Cu2+发生水解反应的平衡常数为5×10-9.



