题目内容
12.下列实验装罝不能达到相应实验目的是( )| A | B | C | D |
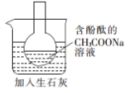 | 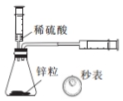 | 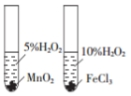 |  |
| 探究温度对盐的水解反应的影响 | 测定一定时间内生成H2的反应速率 | 比较不同催化剂对反应速率的影响 | 量取15.00mL稀盐酸 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.加入生石灰后溶液温度升高,根据溶液颜色变化可以判断温度对盐的水解的影响;
B.根据一定时间内注射器中生成气体的量可以计算生成氢气的速率;
C.比较不同催化剂对反应速率的影响时,双氧水的浓度必须完全相同;
D.滴定管的最小读数为0.01mL,可用酸式滴定管量取稀盐酸.
解答 解:A.醋酸钠水解生成醋酸和氢氧化钠,该反应为可逆反应,石灰石与水的反应为放热反应,加入生石灰后溶液温度升高,可以根据溶液颜色变化判断温度对盐的水解的影响,故A正确;
B.锌与稀硫酸反应生成氢气,通过秒表控制时间,结合注射器中生成氢气的体积可以定一定时间内生成H2的反应速率,故B正确;
C.试管中双氧水的浓度不同、催化剂类型不同,有两个变量,无法比较不同催化剂对反应速率的影响,故C错误;
D.稀硫酸呈酸性,且滴定管的最小读数为0.01mL,可用酸式滴定管量取15.00mL稀盐酸,故D正确;
故选B.
点评 本题考查了化学实验方案的评价,题目难度中等,涉及盐的水解原理、反应速率影响及测定、滴定管使用等知识,明确常见化学实验基本操作方法为解答关键,注意掌握化学反应速率及其影响,试题培养了学生的分析能力及化学实验能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.氯气用于自来水的杀菌消毒,但在消毒时会产生一些负面影响,因此人们开始研究一些新型自来水消毒剂.某学习小组查阅资料发现NCl3可作为杀菌消毒剂,
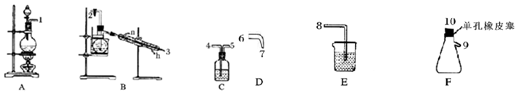
该小组利用图所示的装置制备NCl3,并探究NCl3的漂白性.
NCl3的相关性质如下:
回答下列问题:
(1)根据实验目的,接口连接的顺序为1→4→5→2→3→6→7→10→9→8.
(2)C装置作用是除去氯气中氯化氢气体.
(3)B装置中发生反应的化学方程式为3Cl2+NH4Cl═NCl3+4HCl,当B装置蒸馏烧瓶中出现较多油状液体后,关闭接口2处的活塞,控制水浴加热的温度为71~95℃.
(4)当F装置的锥形瓶内有较多黄色油状液体出现时,用干燥、洁净的玻璃棒蘸取该液体滴到干燥的红色石蕊试纸上,试纸不褪色;若取该液体滴入50-60℃热水中,片刻后取该热水再滴到干燥的红色石蕊试纸上,试纸先变蓝后褪色,写出有关化学反应方程式并解释实验现象:NCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$3HClO+NH3;NCl3本身无漂白性;NCl3在热水中水解生成NH3•H2O使红色石蕊试纸变蓝,生成的HClO又使其漂白褪色.

该小组利用图所示的装置制备NCl3,并探究NCl3的漂白性.
NCl3的相关性质如下:
| 物理性质 | 制备原理 | 化学性质 |
| 黄色油状液体,熔点为-40℃,沸点为71℃,不溶于冷水,易溶于有机溶剂,密度为1.65g/mL | Cl2与NH4Cl水溶液在低温下反应 | 95℃爆炸,热水中能与水反应 |
(1)根据实验目的,接口连接的顺序为1→4→5→2→3→6→7→10→9→8.
(2)C装置作用是除去氯气中氯化氢气体.
(3)B装置中发生反应的化学方程式为3Cl2+NH4Cl═NCl3+4HCl,当B装置蒸馏烧瓶中出现较多油状液体后,关闭接口2处的活塞,控制水浴加热的温度为71~95℃.
(4)当F装置的锥形瓶内有较多黄色油状液体出现时,用干燥、洁净的玻璃棒蘸取该液体滴到干燥的红色石蕊试纸上,试纸不褪色;若取该液体滴入50-60℃热水中,片刻后取该热水再滴到干燥的红色石蕊试纸上,试纸先变蓝后褪色,写出有关化学反应方程式并解释实验现象:NCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$3HClO+NH3;NCl3本身无漂白性;NCl3在热水中水解生成NH3•H2O使红色石蕊试纸变蓝,生成的HClO又使其漂白褪色.
3.表是周期表中的一部分,根据A-I在周期表中的位置,用元素符号或化学式回答下列问题:
(1)表中元素,化学性质最不活泼的是Ne,只有负价而无正价的是F,氧化性最强的单质是F2.
(2)最高价氧化物的水化物碱性最强的是NaOH,酸性最强的是HClO4.
(3)A分别与G、H形成的化合物中,酸性强的是HCl.
(4)G、H的单质与水反应,更剧烈的是F2.
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
(2)最高价氧化物的水化物碱性最强的是NaOH,酸性最强的是HClO4.
(3)A分别与G、H形成的化合物中,酸性强的是HCl.
(4)G、H的单质与水反应,更剧烈的是F2.
20.能正确表示下列反应的离子方程式的是( )
| A. | 用过量氨水吸收工业尾气中的SO2:2NH3•H2O+SO2═2NH4++SO32-+H2O | |
| B. | 氯化钠与浓硫酸混合加热:H++Cl-$\frac{\underline{\;\;△\;\;}}{\;}$HCl↑ | |
| C. | 磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+3H2O | |
| D. | 明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++3OH-+Al3++2SO42-═2BaSO4↓+Al(OH)3↓ |
7.某溶液pH=1,该溶液中可能含有Fe3+、NO3-、I-、Cl-中的一种或几种,向该溶液中滴入溴水,单质溴被还原,由此推断该溶液中( )
| A. | 含Fe3+和NO3-,无I-和Cl- | B. | 含I-,不含Fe3+、NO3-,可能有Cl- | ||
| C. | 含NO3-,不含Fe3+、I-,可能有Cl- | D. | 含I-、Fe3+,不含Cl-,可能有NO3- |
17.铜及其化合物在工农业生产及日常生活中应用非常广泛.回答下列问题:
(1)纳米级Cu2O由于具有优良的催化性能而受到关注,制取Cu2O的两种方法如表所示.
①方法I中还原剂与氧化剂的物质的量之比为1:4.
②方法II发生反应的化学方程式为4Cu(OH)2+N2H4=Cu2O+N2↑+6H2O.
(2)氢化亚铜是一种红色同体,可由下列反应制备:4CuSO4+3H3PO2+6H2O=4CuH↓+4H2SO4+3H3PO4
该反应中每转移3mol电子,生成CuH的物质的量为1mol.
(3)氯化铜溶液中各种含铜微粒的分布分数(平衡时某微粒的浓度占各微粒浓度之和的分数)与c(C1-)之间的关系如图所示.
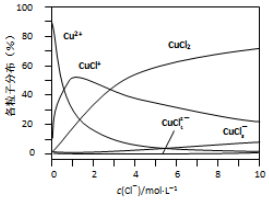
①当c(C1-)=9mol/L时,溶液中3种主要含铜微粒浓度的大小关系为c(CuCl2)>c(CuCl+)>c(CuCl3-).
②在c(C1-)=l mol/L的氯化铜溶液中,加人AgNO3溶液,CuCl+转化为Cu2+的离子方程式为CuCl++Ag+=Cu2++AgCl↓.
(4)已知:Cu(OH)2是二元弱碱,25℃时Ksp=2.0×10-20.则此温度下在铜盐溶液中Cu2+发生水解反应的平衡常数为5×10-9.
(1)纳米级Cu2O由于具有优良的催化性能而受到关注,制取Cu2O的两种方法如表所示.
| 方法I | 用炭粉在高温条件下还原CuO生成Cu2O和CO2 |
| 方法II | 用肼(N2H4)还原新制Cu(OH)2 |
②方法II发生反应的化学方程式为4Cu(OH)2+N2H4=Cu2O+N2↑+6H2O.
(2)氢化亚铜是一种红色同体,可由下列反应制备:4CuSO4+3H3PO2+6H2O=4CuH↓+4H2SO4+3H3PO4
该反应中每转移3mol电子,生成CuH的物质的量为1mol.
(3)氯化铜溶液中各种含铜微粒的分布分数(平衡时某微粒的浓度占各微粒浓度之和的分数)与c(C1-)之间的关系如图所示.

①当c(C1-)=9mol/L时,溶液中3种主要含铜微粒浓度的大小关系为c(CuCl2)>c(CuCl+)>c(CuCl3-).
②在c(C1-)=l mol/L的氯化铜溶液中,加人AgNO3溶液,CuCl+转化为Cu2+的离子方程式为CuCl++Ag+=Cu2++AgCl↓.
(4)已知:Cu(OH)2是二元弱碱,25℃时Ksp=2.0×10-20.则此温度下在铜盐溶液中Cu2+发生水解反应的平衡常数为5×10-9.
1.下列物质属于电解质的是( )
| A. | 铁 | B. | 二氧化碳 | C. | 浓硫酸 | D. | 氯化钙 |
6.已知2A2(g)+B2(g)?2C3(g);△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2molA2和1molB2,在500℃时充分反应达平衡后C3的浓度为wmol/L,放出热量bkJ.
(1)比较a>b(填>、=、<)
(2)下表为不同温度下该反应的平衡常数.
若在原来的容器中,只加入2molC3,500℃时充分反应达平衡后,吸收热量ckJ,C3的浓度=(填>、=、<)wmol/L,a、b、c之间满足何种关系a=b+c(用代数式表示).
(3)为使该反应的反应速率增大,且平衡向正反应方向移动的是C.
A.及时分离出C3气体 B.适当升高温度
C.增大B2的浓度 D.选择高效的催化剂
(4)若将上述容器改为恒压容器(反应前体积相同),起始时加入2molA2和1molB2,500℃时充分反应达平衡后,放出热量dkJ,则d>b(填>、=、<).
(5)在一定温度下,向一个容积不变的容器中,通入3molA2 和2molB2及固体催化剂,使之反应,平衡时容器内气体压强为起始时的90%.保持同一反应温度,在相同容器中,将起始物质的量改为4molA2、3molB2、2molC3,则平衡时A2的转化率变大(填“不变”、“变大”、“变小”或“不能确定”)
(6)碳酸锶广泛应用于电子工业.以天青石(主要成分为SrSO4)为基本原料制备碳酸锶.(已知:Ksp(SrSO4)=3.2×10-7,Ksp(SrCO3)=1.1×10-10.)
①将天青石矿粉与Na2CO3溶液搅拌混匀、加热,发生的离子反应方程式为:SrSO4+CO32-═SrCO3+SO42-.
②当转化完成时,混合液中c(CO32-)=1.0×10-3mol/L,c(SO42-)=2.91mol/L.
(1)比较a>b(填>、=、<)
(2)下表为不同温度下该反应的平衡常数.
| T/K | T1 | T2 | T3 |
| K | 1.00×107 | 2.54×105 | 1.88×103 |
(3)为使该反应的反应速率增大,且平衡向正反应方向移动的是C.
A.及时分离出C3气体 B.适当升高温度
C.增大B2的浓度 D.选择高效的催化剂
(4)若将上述容器改为恒压容器(反应前体积相同),起始时加入2molA2和1molB2,500℃时充分反应达平衡后,放出热量dkJ,则d>b(填>、=、<).
(5)在一定温度下,向一个容积不变的容器中,通入3molA2 和2molB2及固体催化剂,使之反应,平衡时容器内气体压强为起始时的90%.保持同一反应温度,在相同容器中,将起始物质的量改为4molA2、3molB2、2molC3,则平衡时A2的转化率变大(填“不变”、“变大”、“变小”或“不能确定”)
(6)碳酸锶广泛应用于电子工业.以天青石(主要成分为SrSO4)为基本原料制备碳酸锶.(已知:Ksp(SrSO4)=3.2×10-7,Ksp(SrCO3)=1.1×10-10.)
①将天青石矿粉与Na2CO3溶液搅拌混匀、加热,发生的离子反应方程式为:SrSO4+CO32-═SrCO3+SO42-.
②当转化完成时,混合液中c(CO32-)=1.0×10-3mol/L,c(SO42-)=2.91mol/L.
 如图所示装置可构成原电池.试回答下列问题:
如图所示装置可构成原电池.试回答下列问题: