题目内容
13.有一铝铁混合物,甲、乙同学为了研究它的组成,分别取等质量的两份样品进行实验:(1)甲向样品中加入一定浓度的稀盐酸,样品全部溶解,共收集到11.2L气体;
(2)乙向样品中加入一定浓度的足量NaOH溶液,充分反应后,共收集到6.72L气体; (气体体积都是标准状况下的体积)求样品中铝与铁的物质的量分别是多少?
分析 金属铝可以和氢氧化钠之间反应,但是铁不会反应,金属铝、铁可以和盐酸之间反应,根据发生反应的方程式进行计算,实验中会发生的反应:2Al+6HCl=2AlCl3+3H2↑;2Al+2NaOH+2H2O=2NaAlO2+3H2↑;Fe+2HCl═FeCl2+H2↑.
解答 解:乙向样品中加入一定浓度的足量NaOH溶液,只发生反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,收集到6.72L即0.3mol,气体消耗金属铝的物质的量是0.2mol,所以金属铝的物质的量是0.2mol;
甲向样品中加入一定浓度的稀盐酸,样品全部溶解,发生反应:2Al+6HCl=2AlCl3+3H2↑,Fe+2HCl═FeCl2+H2↑,共收集到11.2L即0.5mol气体;
金属铝的物质的量是0.2mol,会产生氢气0.3mol,所以全部的金属铁产生氢气是0.2mol,所以铁的物质的量是0.2mol,
答:样品中铝与铁的物质的量分别是n(Fe)=0.2mol;n(Al)=0.2mol.
点评 本题主要涉及金属铁和铝的化学性质以及根据化学方程式的计算等知识,属于综合知识的考查题,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.下列元素属于ds区的是( )
| A. | Ca | B. | Fe | C. | Cu | D. | P |
4.甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应Ⅰ和Ⅱ来制备甲醇.请回答下列问题:
(1)将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L)中,在一定条件下发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g)(Ⅰ)
CH4的转化率与温度、压强的关系如图1所示.
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为0.003mol•L-1•min-1.
②图中的p1<p2(填“<”、“>”或“=”),100℃时的平衡常数为2.25×10-4.
③该反应的△H>0,△S>0(填“<”、“>”或“=”).
(2)在压强为0.1MPa条件下,a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:
CO(g)+2H2(g)?CH3OH△H<0 (Ⅱ)
①若容器的容积不变,下列措施可增大甲醇产率的是ABD(填序号).
A.降低温度
B.将CH3OH(g)从体系中分离出来
C.恒容下充入He,使体系的总压强增大
D.再充入a mol CO和3a mol H2
②为了寻找合成甲醇的适宜温度和压强,某同学设计了三组实验,部分实验条件已经填在了下面的实验设计表中.
a.表中剩余的实验数据:n=180,m=$\frac{2}{3}$.
b.根据反应Ⅱ的特点,如图是在压强分别为0.2MPa和5MPa下CO的转化率随温度变化的曲线,请指明图2中的压强px=0.2MPa.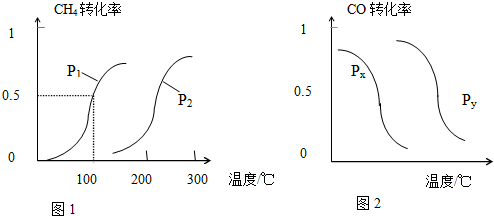
(1)将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L)中,在一定条件下发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g)(Ⅰ)
CH4的转化率与温度、压强的关系如图1所示.
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为0.003mol•L-1•min-1.
②图中的p1<p2(填“<”、“>”或“=”),100℃时的平衡常数为2.25×10-4.
③该反应的△H>0,△S>0(填“<”、“>”或“=”).
(2)在压强为0.1MPa条件下,a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:
CO(g)+2H2(g)?CH3OH△H<0 (Ⅱ)
①若容器的容积不变,下列措施可增大甲醇产率的是ABD(填序号).
A.降低温度
B.将CH3OH(g)从体系中分离出来
C.恒容下充入He,使体系的总压强增大
D.再充入a mol CO和3a mol H2
②为了寻找合成甲醇的适宜温度和压强,某同学设计了三组实验,部分实验条件已经填在了下面的实验设计表中.
| 实验编号 | T(℃) | n(CO)/n(H2) | P(MPa) |
| 1 | 180 | $\frac{2}{3}$ | 0.1 |
| 2 | n | $\frac{2}{3}$ | 5 |
| 3 | 350 | m | 5 |
b.根据反应Ⅱ的特点,如图是在压强分别为0.2MPa和5MPa下CO的转化率随温度变化的曲线,请指明图2中的压强px=0.2MPa.

18.下列实验操作中错误的是( )
| A. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 蒸馏中,冷却水应从冷凝管的下口通入,上口流出 | |
| D. | 过滤操作时,漏斗颈下端不能紧靠烧杯内壁 |
5.用NA表示阿伏伽德罗常数的数值,下列叙述正确的是( )
| A. | 在同温同压下,相同体积的任何气体单质所含的分子数目一定相同 | |
| B. | 1L 0.5mol/L FeCl3溶液完全转化可得0.5NA个Fe(OH)3胶粒 | |
| C. | 标准状况下,22.4L苯含有的分子数为1NA | |
| D. | 在常温常压下,11.2 L氮气所含的原子数目为NA |
2.氯气用于自来水的杀菌消毒,但在消毒时会产生一些负面影响,因此人们开始研究一些新型自来水消毒剂.某学习小组查阅资料发现NCl3可作为杀菌消毒剂,
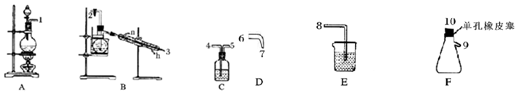
该小组利用图所示的装置制备NCl3,并探究NCl3的漂白性.
NCl3的相关性质如下:
回答下列问题:
(1)根据实验目的,接口连接的顺序为1→4→5→2→3→6→7→10→9→8.
(2)C装置作用是除去氯气中氯化氢气体.
(3)B装置中发生反应的化学方程式为3Cl2+NH4Cl═NCl3+4HCl,当B装置蒸馏烧瓶中出现较多油状液体后,关闭接口2处的活塞,控制水浴加热的温度为71~95℃.
(4)当F装置的锥形瓶内有较多黄色油状液体出现时,用干燥、洁净的玻璃棒蘸取该液体滴到干燥的红色石蕊试纸上,试纸不褪色;若取该液体滴入50-60℃热水中,片刻后取该热水再滴到干燥的红色石蕊试纸上,试纸先变蓝后褪色,写出有关化学反应方程式并解释实验现象:NCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$3HClO+NH3;NCl3本身无漂白性;NCl3在热水中水解生成NH3•H2O使红色石蕊试纸变蓝,生成的HClO又使其漂白褪色.

该小组利用图所示的装置制备NCl3,并探究NCl3的漂白性.
NCl3的相关性质如下:
| 物理性质 | 制备原理 | 化学性质 |
| 黄色油状液体,熔点为-40℃,沸点为71℃,不溶于冷水,易溶于有机溶剂,密度为1.65g/mL | Cl2与NH4Cl水溶液在低温下反应 | 95℃爆炸,热水中能与水反应 |
(1)根据实验目的,接口连接的顺序为1→4→5→2→3→6→7→10→9→8.
(2)C装置作用是除去氯气中氯化氢气体.
(3)B装置中发生反应的化学方程式为3Cl2+NH4Cl═NCl3+4HCl,当B装置蒸馏烧瓶中出现较多油状液体后,关闭接口2处的活塞,控制水浴加热的温度为71~95℃.
(4)当F装置的锥形瓶内有较多黄色油状液体出现时,用干燥、洁净的玻璃棒蘸取该液体滴到干燥的红色石蕊试纸上,试纸不褪色;若取该液体滴入50-60℃热水中,片刻后取该热水再滴到干燥的红色石蕊试纸上,试纸先变蓝后褪色,写出有关化学反应方程式并解释实验现象:NCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$3HClO+NH3;NCl3本身无漂白性;NCl3在热水中水解生成NH3•H2O使红色石蕊试纸变蓝,生成的HClO又使其漂白褪色.
3.表是周期表中的一部分,根据A-I在周期表中的位置,用元素符号或化学式回答下列问题:
(1)表中元素,化学性质最不活泼的是Ne,只有负价而无正价的是F,氧化性最强的单质是F2.
(2)最高价氧化物的水化物碱性最强的是NaOH,酸性最强的是HClO4.
(3)A分别与G、H形成的化合物中,酸性强的是HCl.
(4)G、H的单质与水反应,更剧烈的是F2.
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
(2)最高价氧化物的水化物碱性最强的是NaOH,酸性最强的是HClO4.
(3)A分别与G、H形成的化合物中,酸性强的是HCl.
(4)G、H的单质与水反应,更剧烈的是F2.