题目内容
11.下列有关实验装置进行的相应实验,能达到实验目的是( )| A. |  用图 1所示装置除去乙烯中少量 SO2 气体 | |
| B. |  用图 装置量取 20.00 mL 0.10 mol•L-1硫酸 | |
| C. |  用图 装置能验证 HCl 气体在水中的溶解性 | |
| D. |  用图 装置从碘的 CCl4溶液中分离出碘 |
分析 A.乙烯、二氧化硫均能被高锰酸钾氧化;
B.图中为碱式滴定管;
C.HCl极易溶于水,挤压胶头滴管,气球变大;
D.碘的 CCl4溶液互溶,沸点不同.
解答 解:A.乙烯、二氧化硫均能被高锰酸钾氧化,不能除去,故A错误;
B.图中为碱式滴定管,应选酸式滴定管量取 20.00 mL 0.10 mol•L-1硫酸,故B错误;
C.HCl极易溶于水,挤压胶头滴管,气球变大,图中装置可验证 HCl 气体在水中的溶解性,故C正确;
D.碘的 CCl4溶液互溶,沸点不同,应选蒸馏法分离,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握实验装置的作用、混合物分离提纯、实验操作、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案
相关题目
2.氯气用于自来水的杀菌消毒,但在消毒时会产生一些负面影响,因此人们开始研究一些新型自来水消毒剂.某学习小组查阅资料发现NCl3可作为杀菌消毒剂,
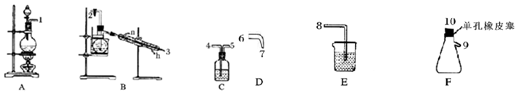
该小组利用图所示的装置制备NCl3,并探究NCl3的漂白性.
NCl3的相关性质如下:
回答下列问题:
(1)根据实验目的,接口连接的顺序为1→4→5→2→3→6→7→10→9→8.
(2)C装置作用是除去氯气中氯化氢气体.
(3)B装置中发生反应的化学方程式为3Cl2+NH4Cl═NCl3+4HCl,当B装置蒸馏烧瓶中出现较多油状液体后,关闭接口2处的活塞,控制水浴加热的温度为71~95℃.
(4)当F装置的锥形瓶内有较多黄色油状液体出现时,用干燥、洁净的玻璃棒蘸取该液体滴到干燥的红色石蕊试纸上,试纸不褪色;若取该液体滴入50-60℃热水中,片刻后取该热水再滴到干燥的红色石蕊试纸上,试纸先变蓝后褪色,写出有关化学反应方程式并解释实验现象:NCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$3HClO+NH3;NCl3本身无漂白性;NCl3在热水中水解生成NH3•H2O使红色石蕊试纸变蓝,生成的HClO又使其漂白褪色.

该小组利用图所示的装置制备NCl3,并探究NCl3的漂白性.
NCl3的相关性质如下:
| 物理性质 | 制备原理 | 化学性质 |
| 黄色油状液体,熔点为-40℃,沸点为71℃,不溶于冷水,易溶于有机溶剂,密度为1.65g/mL | Cl2与NH4Cl水溶液在低温下反应 | 95℃爆炸,热水中能与水反应 |
(1)根据实验目的,接口连接的顺序为1→4→5→2→3→6→7→10→9→8.
(2)C装置作用是除去氯气中氯化氢气体.
(3)B装置中发生反应的化学方程式为3Cl2+NH4Cl═NCl3+4HCl,当B装置蒸馏烧瓶中出现较多油状液体后,关闭接口2处的活塞,控制水浴加热的温度为71~95℃.
(4)当F装置的锥形瓶内有较多黄色油状液体出现时,用干燥、洁净的玻璃棒蘸取该液体滴到干燥的红色石蕊试纸上,试纸不褪色;若取该液体滴入50-60℃热水中,片刻后取该热水再滴到干燥的红色石蕊试纸上,试纸先变蓝后褪色,写出有关化学反应方程式并解释实验现象:NCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$3HClO+NH3;NCl3本身无漂白性;NCl3在热水中水解生成NH3•H2O使红色石蕊试纸变蓝,生成的HClO又使其漂白褪色.
19.已知X2、Y2、Z2、W2四种物质的氧化能力依次减弱的顺序为W2、Z2、X2、Y2,下列氧化还原反应能发生的是( )
| A. | 2W-+Z2═2Z-+W2 | B. | 2X-+Z2═2Z-+X2 | C. | 2Y-+W2═2W-+Y2 | D. | 2Z-+X2═2X-+Z2 |
3.表是周期表中的一部分,根据A-I在周期表中的位置,用元素符号或化学式回答下列问题:
(1)表中元素,化学性质最不活泼的是Ne,只有负价而无正价的是F,氧化性最强的单质是F2.
(2)最高价氧化物的水化物碱性最强的是NaOH,酸性最强的是HClO4.
(3)A分别与G、H形成的化合物中,酸性强的是HCl.
(4)G、H的单质与水反应,更剧烈的是F2.
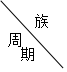 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
(2)最高价氧化物的水化物碱性最强的是NaOH,酸性最强的是HClO4.
(3)A分别与G、H形成的化合物中,酸性强的是HCl.
(4)G、H的单质与水反应,更剧烈的是F2.
20.能正确表示下列反应的离子方程式的是( )
| A. | 用过量氨水吸收工业尾气中的SO2:2NH3•H2O+SO2═2NH4++SO32-+H2O | |
| B. | 氯化钠与浓硫酸混合加热:H++Cl-$\frac{\underline{\;\;△\;\;}}{\;}$HCl↑ | |
| C. | 磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+3H2O | |
| D. | 明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++3OH-+Al3++2SO42-═2BaSO4↓+Al(OH)3↓ |
1.下列物质属于电解质的是( )
| A. | 铁 | B. | 二氧化碳 | C. | 浓硫酸 | D. | 氯化钙 |



