��Ŀ����
11���ʻ���COS������Ϊһ����ʳѬ�������ܷ�ֹijЩ���桢�߳�������Σ�����ں����ܱ������У���CO��H2S��ϼ��Ȳ��ﵽ����ƽ�⣺CO��g��+H2S��g��?COS��g��+H2��g����K=0.1����ӦǰCO�����ʵ���Ϊ10mol��ƽ���CO���ʵ���Ϊ8mol������˵����ȷ���ǣ�������| A�� | �����¶ȣ�H2SŨ�����ӣ������÷�Ӧ�ġ�H��0 | |
| B�� | ���ŷ�Ӧ�Ľ��У����������ܶ���С | |
| C�� | ��ӦǰH2S���ʵ���Ϊ7mol | |
| D�� | CO��ƽ��ת����Ϊ80% |
���� A�������¶ȣ�H2SŨ�����ӣ�˵��ƽ�������ƶ��������¶ȣ�ƽ�������ȷ�Ӧ�����ƶ���
B�������������䣬���ܶȲ��䣻
C����ӦǰCO�����ʵ���Ϊ10mol��ƽ���CO���ʵ���Ϊ8mol���跴ӦǰH2S���ʵ���Ϊn����
CO��g��+H2S��g��?COS��g��+H2��g��
��ʼ��mol����10 n 0 0
�仯��mol����2 2 2 2
ƽ�⣨mol����8 n-2 2 2
��Ӧǡ�����������Ŀ���䣬�������ʵ�������Ũ�ȴ���ƽ�ⳣ������ʽK=$\frac{c��COS����c��{H}_{2}��}{c��CO����c��{H}_{2}S��}$�з��̼��㣻
D������C�еļ������ݼ���CO��ƽ��ת���ʣ�
��� �⣺A�������¶ȣ�H2SŨ�����ӣ�˵��ƽ�������ƶ��������¶ȣ�ƽ�������ȷ�Ӧ�����ƶ�����÷�Ӧ�Ƿ��ȷ�Ӧ����A����
B�������������䣬��������䣬���ܶȲ��䣬��B����
C����ӦǰCO�����ʵ���Ϊ10mol��ƽ���CO���ʵ���Ϊ8mol���跴ӦǰH2S���ʵ���Ϊn����
CO��g��+H2S��g��?COS��g��+H2��g��
��ʼ��mol����10 n 0 0
�仯��mol����2 2 2 2
ƽ�⣨mol����8 n-2 2 2
��Ӧǡ�����������Ŀ���䣬�������ʵ�������Ũ�ȴ���ƽ�ⳣ������ʽK=$\frac{c��COS����c��{H}_{2}��}{c��CO����c��{H}_{2}S��}$=$\frac{2��2}{8����n-2��}$=0.1�����n=7����C��ȷ��
D�������������ݣ���֪CO��ƽ��ת����Ϊ$\frac{2mol}{10mol}$��100%=20%����D����
��ѡC��
���� ���⿼��Ӱ�컯ѧ��Ӧ���ʵ����ء���ѧƽ�ⳣ��Ӧ�á���ѧƽ����йؼ��㣬Ϊ��Ƶ���㣬���ؿ���ѧ���ķ��������ͼ���������ע��������������ʽ�����ⷨ�ڻ�ѧƽ������е�Ӧ�ã��Ѷ��еȣ�

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�| A�� | v��A��=0.5 mol/��L•s�� | B�� | v��B��=0.3mol/��L•s�� | C�� | v��C��=0.6 mol/��L•s�� | D�� | v��D��=1 mol/��L•s�� |
| A�� | Ca | B�� | Fe | C�� | Cu | D�� | P |
| A�� | �٢ڢۢܢݢ� | B�� | �ۢܢޢ� | C�� | �٢ڢޢ� | D�� | �ڢۢܢ� |
| A�� | 1 | B�� | 2 | C�� | 3 | D�� | 4 |
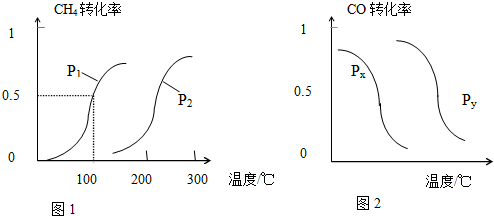
��1����1.0mol CH4��2.0mol H2O��g��ͨ�뷴Ӧ�ң��ݻ�Ϊ100L���У���һ�������·�����Ӧ��CH4��g��+H2O��g��?CO��g��+3H2��g������
CH4��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ1��ʾ��
����֪100��ʱ�ﵽƽ�������ʱ��Ϊ5min������H2��ʾ��ƽ����Ӧ����Ϊ0.003mol•L-1•min-1��
��ͼ�е�p1��p2�����������������=������100��ʱ��ƽ�ⳣ��Ϊ2.25��10-4��
�۸÷�Ӧ�ġ�H��0����S��0�����������������=������
��2����ѹǿΪ0.1MPa�����£�a mol CO��3a mol H2�Ļ�������ڴ������������Է���Ӧ���ɼ״���
CO��g��+2H2��g��?CH3OH��H��0 ����
�����������ݻ����䣬���д�ʩ������״����ʵ���ABD������ţ���
A�������¶�
B����CH3OH��g������ϵ�з������
C�������³���He��ʹ��ϵ����ѹǿ����
D���ٳ���a mol CO��3a mol H2
��Ϊ��Ѱ�Һϳɼ״��������¶Ⱥ�ѹǿ��ijͬѧ���������ʵ�飬����ʵ�������Ѿ������������ʵ����Ʊ��У�
| ʵ���� | T���棩 | n��CO��/n��H2�� | P��MPa�� |
| 1 | 180 | $\frac{2}{3}$ | 0.1 |
| 2 | n | $\frac{2}{3}$ | 5 |
| 3 | 350 | m | 5 |
b�����ݷ�Ӧ����ص㣬��ͼ����ѹǿ�ֱ�Ϊ0.2MPa��5MPa��CO��ת�������¶ȱ仯�����ߣ���ָ��ͼ2�е�ѹǿpx=0.2MPa��
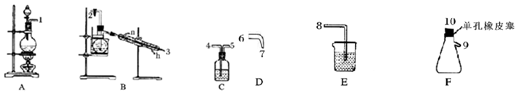
��С������ͼ��ʾ��װ���Ʊ�NCl3����̽��NCl3��Ư���ԣ�
NCl3������������£�
| �������� | �Ʊ�ԭ�� | ��ѧ���� |
| ��ɫ��״Һ�壬�۵�Ϊ-40�棬�е�Ϊ71�棬��������ˮ���������л��ܼ����ܶ�Ϊ1.65g/mL | Cl2��NH4Clˮ��Һ�ڵ����·�Ӧ | 95�汬ը����ˮ������ˮ��Ӧ |
��1������ʵ��Ŀ�ģ��ӿ����ӵ�˳��Ϊ1��4��5��2��3��6��7��10��9��8��
��2��Cװ�������dz�ȥ�������Ȼ������壮
��3��Bװ���з�����Ӧ�Ļ�ѧ����ʽΪ3Cl2+NH4Cl�TNCl3+4HCl����Bװ��������ƿ�г��ֽ϶���״Һ��رսӿ�2���Ļ���������ˮԡ���ȵ��¶�Ϊ71��95�森
��4����Fװ�õ���ƿ���н϶��ɫ��״Һ�����ʱ���ø���ྻ�IJ�����պȡ��Һ��ε�����ĺ�ɫʯ����ֽ�ϣ���ֽ����ɫ����ȡ��Һ�����50-60����ˮ�У�Ƭ�̺�ȡ����ˮ�ٵε�����ĺ�ɫʯ����ֽ�ϣ���ֽ�ȱ�������ɫ��д���йػ�ѧ��Ӧ����ʽ������ʵ������NCl3+3H2O$\frac{\underline{\;\;��\;\;}}{\;}$3HClO+NH3��NCl3������Ư���ԣ�NCl3����ˮ��ˮ������NH3•H2Oʹ��ɫʯ����ֽ���������ɵ�HClO��ʹ��Ư����ɫ��