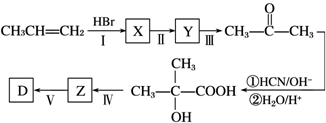
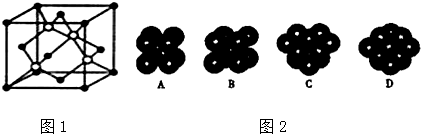
题目内容
3.下列离子方程式正确的是( )| A. | 向Ca(HCO3)2溶液中加入足量的NaOH溶液:Ca2++HCO3-+OH-→CaCO3↓+H2O | |
| B. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2使SO42ˉ恰好完全反应:2Ba2++4OH-+Al3++2SO42-→BaSO4↓+AlO2-+2H2O | |
| C. | 足量的CO2通入饱和碳酸钠溶液中:CO2+CO32-+H2O→2HCO3- | |
| D. | 向Fe2(SO4)3溶液中加入过量Na2S溶液:2Fe3++3S2-→2FeS↓+S↓ |
分析 A.氢氧化钠足量,反应生成碳酸钙沉淀、碳酸钠和水;
B.硫酸根离子恰好沉淀完全时,铝离子与氢氧根离子的物质的量之比为1:4,铵根离子结合氢氧根离子能力大于氢氧化铝,所以反应生成氢氧化铝沉淀和一水合氨;
C.碳酸氢钠的溶解度小于碳酸钠,反应析出碳酸氢钠固体;
D.铁离子具有氧化性,能够氧化硫离子.
解答 解:A.向Ca(HCO3)2溶液中加入足量的NaOH溶液,反应生成碳酸钙沉淀、碳酸钠和水,正确的离子方程式为:Ca2++2HCO3-+2OH-→CaCO3↓+2H2O+CO32-,故A错误;
B.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀,反应生成硫酸钡、氢氧化铝沉淀和一水合氨,正确的离子方程式为:2Ba2++NH4++Al3++2SO42-+4OH-═Al(OH)3↓+NH3•H2O+2BaSO4↓,故B错误;
C.向饱和碳酸钠溶液中通入足量二氧化碳气体,正确的离子方程式:2Na++CO32-+H2O+CO2=2NaHCO3↓,故C错误;
D.向Fe2(SO4)3溶液中加入过量Na2S溶液,二者发生氧化还原反应,反应的离子方程式为:2Fe3++3S2-→2FeS↓+S↓,故D正确;
故选D.
点评 本题考查了离子方程式的书写判断,为高考的高频题,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.下列事实能说明HA酸是弱电解质的是( )
| A. | HA溶液的导电性比强酸弱 | |
| B. | 10 mL 1 mol/L的HA溶液与10 mL 1 mol/L的NaOH溶液恰好完全反应 | |
| C. | NaA溶液的pH>7 | |
| D. | 0.1 mol/L HA溶液的pH=1 |
14.分类是学习和研究化学物质的一种常用的科学方法,下列说法正确的是( )
| A. | 高锰酸钾中含有氧元素,属于氧化物 | |
| B. | 一氧化碳中含有碳元素,属于有机物 | |
| C. | 纯碱溶液显碱性,属于碱 | |
| D. | 绿矾的化学式为FeSO4•7H2O,属于纯净物 |
11.下列有关乙烯气体和乙醇蒸气的说法正确的是( )
| A. | 二者等物质的量完全燃烧消耗等量的氧气 | |
| B. | 二者分子所有原子都处于同一个平面上 | |
| C. | 二者能相互转化且反应属于可逆反应 | |
| D. | 二者可用酸性高锰酸钾溶液鉴别 |




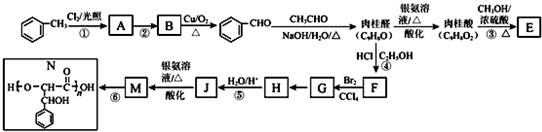
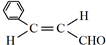 .
. .
. .
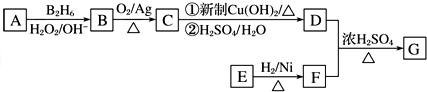
.
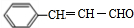 .
.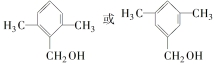 .
.