题目内容
下表是部分短周期元素的原子半径及主要化合价,根据表中信息,下列叙述正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A、L2+与R2-的核外电子数相等 |
| B、气态氢化物的热稳定性:H2T>H2R |
| C、M与T形成的化合物能溶于氨水溶液 |
| D、相同条件下,单质与同浓度稀盐酸反应的速率:M>L |
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:短周期元素,T、R都有-2价,处于ⅥA族,T只有-2价,则T为O元素、R为S元素,L、Q都有+2价,处于ⅡA族,原子半径L>Q,则L为Mg元素\Q为Be元素,M有+3价,处于ⅢA族,原子半径M的介于L、R之间,则M为Al元素.
解答:
解:短周期元素,T、R都有-2价,处于ⅥA族,T只有-2价,则T为O元素、R为S元素,L、Q都有+2价,处于ⅡA族,原子半径L>Q,则L为Mg元素\Q为Be元素,M有+3价,处于ⅢA族,原子半径M的介于L、R之间,则M为Al元素,
A.L2+的核外电子数为12-2=10,R2-的核外电子数为16-(-2)=18,不相等,故A错误;
B.非金属性O>S,元素的非金属性越强,对应的氢化物越稳定,故B正确;
C.M与T形成的化合物是氧化铝,不能溶于弱碱氨水,故C错误;
D.金属性Mg比Al强,则Mg与酸反应越剧烈,故D错误,
故选B.
A.L2+的核外电子数为12-2=10,R2-的核外电子数为16-(-2)=18,不相等,故A错误;
B.非金属性O>S,元素的非金属性越强,对应的氢化物越稳定,故B正确;
C.M与T形成的化合物是氧化铝,不能溶于弱碱氨水,故C错误;
D.金属性Mg比Al强,则Mg与酸反应越剧烈,故D错误,
故选B.
点评:本题考查元素的性质,学生能利用原子半径及化合价来推断出元素是解答本题的关键,并熟悉元素及其单质、化合物的性质来解答即可,难度不大.

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
 短周期金属元素甲~戊在元素周期表中的相对位置如图所示,下面判断正确的是( )
短周期金属元素甲~戊在元素周期表中的相对位置如图所示,下面判断正确的是( )| A、原子半径:丙<丁<戊 |
| B、元素金属性:甲>丙 |
| C、氢氧化物碱性:丙<丁<戊 |
| D、丙的最高价氧化物水化物与戊的最高价氧化物水化物能发生反应 |
下列电池中不属于二次电池的是( )
| A、碱性锌锰电池 | B、铅蓄电池 |
| C、镍镉电池 | D、锂离子电池 |
咖啡酸具有止血、镇咳、祛痰等疗效,其结构简式为.有关咖啡酸的说法中不正确的是( )
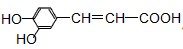
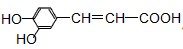
| A、咖啡酸可以发生还原、取代、加聚等反应 |
| B、咖啡酸与FeCl3溶液可以发生显色反应 |
| C、1mol咖啡酸可与4mol H2发生加成反应 |
| D、1mol咖啡酸最多能消耗3mol的NaHCO3 |
 四种短周期元素在周期表中的相对位置如图所示,下列说法错误的是( )
四种短周期元素在周期表中的相对位置如图所示,下列说法错误的是( )| A、X和Y元素的原子最外层电子数之和等于Z元素的原子最外层电子数的2倍 |
| B、Y元素的非金属性强于W元素的,其最高价氧化物水化物的酸性也强于W的 |
| C、X最简单氢化物溶于水呈碱性,Z最简单氢化物溶于水呈酸性 |
| D、W元素形成的单质可以从Z元素氢化物的水溶液中置换出Z单质 |
NA为阿伏加德罗常数,下列说法正确的是( )
| A、标准状况下,5.6L氯气和16.8L氧气的混合气体中含有分子数为NA |
| B、标准状况下,22.4L H2O所含有原子数为3NA |
| C、NA个N2分子所占的体积与0.5NA个H2分子所占的体积比一定是2:1 |
| D、1mol/L NaCl溶液含有2NA个氯离子 |
X、Y、Z、W是短周期元素,X为地壳中含量最高的金属元素;Y原子最外层电子数是电子总数的
;Z的最高正化合价与最低负化合价的代数和为4;W原子在短周期中原子半径最大.下列说法正确的是( )
| 2 |
| 3 |
| A、ZO3和水反应形成的化合物是离子化合物 |
| B、粘在试管内壁上的Z可以用YZ2洗涤 |
| C、最高价氧化物对应水化物的碱性:X>W |
| D、X位于金属与非金属的分界线处,常用来做半导体材料 |
