题目内容
下面是18×7的格子,按要求作答.

(1)用封闭的实线绘出元素周期表的轮廓.注意:不得使用铅笔作图.
(2)“大爆炸理论”指出:200亿年以前,宇宙中所有物质都包含在一个密度无限大,温度无限高的原始核中,由于某种原因它发生了爆炸,首先产生了中子、质子和电子,随后就产生了元素.你由此可知最先产生的元素是 (填写元素名称),其中子数比质子数多1的核素的原子符号是 ;
(3)C、D、E、F的简单离子半径由小到大顺序是 (填写离子符号);
(4)请用电子式表示出E和H形成的化合物形成过程: ;
(5)用实线绘出金属与非金属的分界线.注意:不得使用铅笔作图.
(6)用来组成酸、碱、盐三类物质至少需要的元素有 (填写表中字母).

(1)用封闭的实线绘出元素周期表的轮廓.注意:不得使用铅笔作图.
(2)“大爆炸理论”指出:200亿年以前,宇宙中所有物质都包含在一个密度无限大,温度无限高的原始核中,由于某种原因它发生了爆炸,首先产生了中子、质子和电子,随后就产生了元素.你由此可知最先产生的元素是
(3)C、D、E、F的简单离子半径由小到大顺序是
(4)请用电子式表示出E和H形成的化合物形成过程:
(5)用实线绘出金属与非金属的分界线.注意:不得使用铅笔作图.
(6)用来组成酸、碱、盐三类物质至少需要的元素有
考点:元素周期表的结构及其应用,元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:(1)由元素周期表的结构及边界分析;
(2)首先产生了中子、质子和电子,可知最先产生的元素H,其中子数比质子数多1的核素,其质量数为3;
(3)C、D、E、F的离子中具有相同的电子层结构,原子序数大的离子半径小;
(4)E和H形成的化合物为氯化镁,为离子化合物;
(5)在金属与非金属的交界处如(1)图中台阶式折线;
(6)酸、碱、盐三类物质至少需要的元素H、O、N.
(2)首先产生了中子、质子和电子,可知最先产生的元素H,其中子数比质子数多1的核素,其质量数为3;
(3)C、D、E、F的离子中具有相同的电子层结构,原子序数大的离子半径小;
(4)E和H形成的化合物为氯化镁,为离子化合物;
(5)在金属与非金属的交界处如(1)图中台阶式折线;
(6)酸、碱、盐三类物质至少需要的元素H、O、N.
解答:
解:(1)(5)中周期表的边界及金属与非金属交界如图
 ,
,
故答案为: ;
;
(2)首先产生了中子、质子和电子,可知最先产生的元素为氢,其中子数比质子数多1的核素,其质量数为3,核素可表示为
H或T,故答案为:氢;
H或T;
(3)C、D、E、F的离子中具有相同的电子层结构,原子序数大的离子半径小,则离子半径为Al3+<Mg2+<O2-<N3-,故答案为:Al3+<Mg2+<O2-<N3-;)
(4)E和H形成的化合物为氯化镁,为离子化合物,MgCl2为离子化合物,用电子式表示的形成过程为 ,
,
故答案为: ;
;
(6)酸、碱、盐三类物质至少需要的元素H、O、N,即图中A、C、D元素,故答案为:A、C、D.
 ,
,故答案为:
 ;
;(2)首先产生了中子、质子和电子,可知最先产生的元素为氢,其中子数比质子数多1的核素,其质量数为3,核素可表示为
3 1 |
3 1 |
(3)C、D、E、F的离子中具有相同的电子层结构,原子序数大的离子半径小,则离子半径为Al3+<Mg2+<O2-<N3-,故答案为:Al3+<Mg2+<O2-<N3-;)
(4)E和H形成的化合物为氯化镁,为离子化合物,MgCl2为离子化合物,用电子式表示的形成过程为
 ,
,故答案为:
 ;
;(6)酸、碱、盐三类物质至少需要的元素H、O、N,即图中A、C、D元素,故答案为:A、C、D.
点评:本题考查元素周期表的结构及应用,为高频考点,把握周期表的结构及元素的位置、性质为解答关键,注意离子半径的比较方法,题目难度不大.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案
相关题目
下表是部分短周期元素的原子半径及主要化合价,根据表中信息,下列叙述正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A、L2+与R2-的核外电子数相等 |
| B、气态氢化物的热稳定性:H2T>H2R |
| C、M与T形成的化合物能溶于氨水溶液 |
| D、相同条件下,单质与同浓度稀盐酸反应的速率:M>L |
 (1)在一体积为10L的容器中,通入一定量的CO和H2O,在 800℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,CO和H2O的物质的量浓度变化如图所示,则:
(1)在一体积为10L的容器中,通入一定量的CO和H2O,在 800℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,CO和H2O的物质的量浓度变化如图所示,则: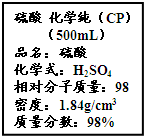 按要求完成下列小题.
按要求完成下列小题. 填写下列空白:
填写下列空白: ,请回答下列问题:
,请回答下列问题: