题目内容
 短周期金属元素甲~戊在元素周期表中的相对位置如图所示,下面判断正确的是( )
短周期金属元素甲~戊在元素周期表中的相对位置如图所示,下面判断正确的是( )| A、原子半径:丙<丁<戊 |
| B、元素金属性:甲>丙 |
| C、氢氧化物碱性:丙<丁<戊 |
| D、丙的最高价氧化物水化物与戊的最高价氧化物水化物能发生反应 |
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由短周期金属元素甲~戊在周期表中的位置可知,甲为Li、乙为Be、丙为Na、丁为Mg、戊为Al,
A.同周期自左而右原子半径减小;
B.同主族自上而下金属性增强;
C.同周期自左而右金属性减弱,最高价氧化物对应水化物的碱性减弱;
D.氢氧化钠与氢氧化铝反应生成偏铝酸钠与水.
A.同周期自左而右原子半径减小;
B.同主族自上而下金属性增强;
C.同周期自左而右金属性减弱,最高价氧化物对应水化物的碱性减弱;
D.氢氧化钠与氢氧化铝反应生成偏铝酸钠与水.
解答:
解:由短周期金属元素甲~戊在周期表中的位置可知,甲为Li、乙为Be、丙为Na、丁为Mg、戊为Al,
A.同周期自左而右原子半径减小,故原子半径丙>丁>戊,故A错误;
B.同主族自上而下金属性增强,故金属性甲<丙,故B错误;
C.同周期自左而右金属性减弱,最高价氧化物对应水化物的碱性减弱,故氢氧化物碱性:丙>丁>戊,故C错误;
D.氢氧化钠与氢氧化铝反应生成偏铝酸钠与水,故D正确,
故选D.
A.同周期自左而右原子半径减小,故原子半径丙>丁>戊,故A错误;
B.同主族自上而下金属性增强,故金属性甲<丙,故B错误;
C.同周期自左而右金属性减弱,最高价氧化物对应水化物的碱性减弱,故氢氧化物碱性:丙>丁>戊,故C错误;
D.氢氧化钠与氢氧化铝反应生成偏铝酸钠与水,故D正确,
故选D.
点评:本题考查元素周期表与元素周期律应用,侧重对元素周期律的考查,比较基础.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
BHT是一种常用的食品抗氧化剂,从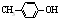 出发合成BHT的方法有如图两种.下列说法错误的是( )
出发合成BHT的方法有如图两种.下列说法错误的是( )
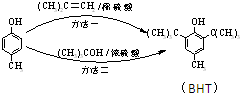
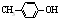 出发合成BHT的方法有如图两种.下列说法错误的是( )
出发合成BHT的方法有如图两种.下列说法错误的是( )
| A、两种方法的反应类型都是加成反应 |
| B、BHT在水中的溶解度小于苯酚 |
C、BHT与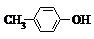 都能使酸性KMnO4褪色 都能使酸性KMnO4褪色 |
| D、从绿色化学角度分析方法一优于方法二 |
2008年北京奥运会“祥云”火炬用的是环保型燃料--丙烷(C3H8),悉尼奥运会火炬所用燃料为65%丁烷(C4H10)和35%丙烷.下列有关说法不正确的是( )
| A、丙烷和丁烷互为同系物,化学性质相似 |
| B、丙烷和丁烷的特征反应均为取代反应 |
| C、C3H8没有同分异构体,C4H10有两种同分异构体 |
| D、等质量的丙烷和丁烷完全燃烧时,后者耗氧量大 |
 图为一种铜锌原电池的示意图,A中盛ZnSO4溶液并插入锌片,B中盛CuSO4溶液并插入铜片,“盐桥”是一支U型管,内装用饱和KCl溶液和琼脂混合制成的胶状溶液,其作用是形成闭合回路.该原电池工作时电流计指针偏转,溶液始终保持电中性,则下列说法正确的是( )
图为一种铜锌原电池的示意图,A中盛ZnSO4溶液并插入锌片,B中盛CuSO4溶液并插入铜片,“盐桥”是一支U型管,内装用饱和KCl溶液和琼脂混合制成的胶状溶液,其作用是形成闭合回路.该原电池工作时电流计指针偏转,溶液始终保持电中性,则下列说法正确的是( )| A、导线上的电流方向为A→B |
| B、A中SO42-浓度有所减小 |
| C、盐桥中Cl-向A中移动 |
| D、B中铜片质量有所增加 |
H2A是一种弱酸,已知常温下0.1mol/L NaHA溶液呈酸性.关于该溶液中微粒浓度的以下判断中,可能错误的是( )
| A、c(A2-)+c(OH-)=c(H2A)+c(H+) |
| B、c(HA-)>c(A2-)>c(H2A) |
| C、c(HA-)>c(H+)>c(OH-) |
| D、c(HA-)>c(OH-)>c(A2-) |
有 Fe3+、Fe2+、NO3-、NH4+、H+和H2O六种微粒,分别属于一个氧化还原反应中的反应物和生成物,下列叙述中,不正确的是( )
| A、还原产物为NH4+ |
| B、氧化剂与还原剂的物质的量之比为1:8 |
| C、若有0.5mol NO3-参加还原反应,则转移电子8mol |
| D、若把该反应设计为电解池,则阳极反应为Fe2+-e→Fe3+ |
下表是部分短周期元素的原子半径及主要化合价,根据表中信息,下列叙述正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A、L2+与R2-的核外电子数相等 |
| B、气态氢化物的热稳定性:H2T>H2R |
| C、M与T形成的化合物能溶于氨水溶液 |
| D、相同条件下,单质与同浓度稀盐酸反应的速率:M>L |
 (1)在一体积为10L的容器中,通入一定量的CO和H2O,在 800℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,CO和H2O的物质的量浓度变化如图所示,则:
(1)在一体积为10L的容器中,通入一定量的CO和H2O,在 800℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,CO和H2O的物质的量浓度变化如图所示,则: