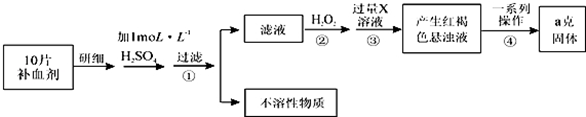
题目内容
15.下列说法正确的是(NA表示阿伏加德罗常数的值)( )| A. | 1 mol聚乙烯含有的原子数目为6NA | |
| B. | 标准状况下1 L己烷完全燃烧后恢复至原状态,生成气态物质分子数为$\frac{5{N}_{A}}{22.4}$ | |
| C. | 1 mol甲基含10NA个电子 | |
| D. | 2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2NA |
分析 A、聚乙烯中的聚合度n的数值不明确;
B、标况下己烷为液体;
C、甲基中含9个电子;
D、乙烯和丙烯的最简式均为CH2.
解答 解:A、聚乙烯中的聚合度n的数值不明确,故1mol聚乙烯中含有的碳原子数无法确定,只能表示为6nNA个,故A错误;
B、标况下己烷为液体,故不能根据气体摩尔体积来计算其物质的量,故B错误;
C、甲基中含9个电子,故1mol甲基中含9NA个电子,故C错误;
D、乙烯和丙烯的最简式均为CH2,故2.8g混合物中含有的CH2的物质的量为0.2mol,故含0.2NA个碳原子,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
相关题目
5.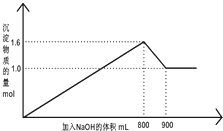 向1L A1Cl3和FeCl3的混合溶液,逐滴加入NaOH 的溶液.产生沉淀的物质的量和加入溶液的体积的关系如图所示,回答下列问题:
向1L A1Cl3和FeCl3的混合溶液,逐滴加入NaOH 的溶液.产生沉淀的物质的量和加入溶液的体积的关系如图所示,回答下列问题:
(1)加入NaOH 溶液900mL 时,溶液中的沉淀是Fe(OH)3,溶液中的溶质是NaCl、NaAlO2.(填化学式)
(2)加入NaOH 溶液800mL 至900mL 之间时,发生的离子反应方程式是Al(OH)3+OH-=AlO2-+2H2O
(3)将混合溶液中各溶质的物质的量浓度填入下表:
(4)加入NaOH 的溶液物质的量浓度为8mol/L.
 向1L A1Cl3和FeCl3的混合溶液,逐滴加入NaOH 的溶液.产生沉淀的物质的量和加入溶液的体积的关系如图所示,回答下列问题:
向1L A1Cl3和FeCl3的混合溶液,逐滴加入NaOH 的溶液.产生沉淀的物质的量和加入溶液的体积的关系如图所示,回答下列问题:(1)加入NaOH 溶液900mL 时,溶液中的沉淀是Fe(OH)3,溶液中的溶质是NaCl、NaAlO2.(填化学式)
(2)加入NaOH 溶液800mL 至900mL 之间时,发生的离子反应方程式是Al(OH)3+OH-=AlO2-+2H2O
(3)将混合溶液中各溶质的物质的量浓度填入下表:
| 溶质 | A1Cl3 | FeCl3 |
| 物质的量浓度 mol/L |
6.水玻璃溶液敞口放置空气中会变质,主要是因为与X反应生成Y,则X和Y分别是( )
| A. | CO2和H4SiO4 | B. | O2和SiO2 | C. | CO2和Na2CO3 | D. | H2和NaOH |
10.某温度下,CuSO4饱和溶液的质量分数为a%,取一定量的此饱和溶液,向其中加入m g无水CuSO4,在温度不变的情况下析出W g CuSO4•5H2O晶体,则原饱和溶液中溶质CuSO4的质量减少( )
| A. | m×a% | B. | W×a% | C. | (m+W)×a% | D. | (W-m)×a% |
20.下列变化中不需要破坏化学键的是( )
| A. | 氯化铵分解 | B. | 干冰气化 | C. | NaCl熔化 | D. | 氯化氢溶于水 |
7.下列物质属于纯净物的是( )
①天然气 ②铝热剂 ③纯碱 ④漂白粉 ⑤胆矾 ⑥纯净的矿泉水⑦氢氧化铁胶体.
①天然气 ②铝热剂 ③纯碱 ④漂白粉 ⑤胆矾 ⑥纯净的矿泉水⑦氢氧化铁胶体.
| A. | ①③⑤⑥ | B. | ③⑤⑥ | C. | ②④⑦ | D. | ③⑤ |
5.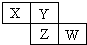 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )| A. | X的气态氢化物能与其最高价氧化物对应的水化物反应生成盐 | |
| B. | 原子半径:X<Y | |
| C. | Z的非金属性比Y的强 | |
| D. | X与Y形成的化合物都易溶于水 |
 甲、乙、丙、丁、戊为原子序数依次增大的短周期元素.甲、丙处于同一主族,丙、丁、戊处于同一周期,戊原子的最外层电子数是甲、乙、丙原子最外层电子数之和.甲、乙组成的常见气体X能使湿润的红色石蕊试纸变蓝;戊的单质与X反应能生成乙的单质,同时生成两种溶于水均呈酸性的化合物Y和Z,0.1 mol/L的Y溶液pH>1;丁的单质既能与丙元素最高价氧化物的水化物的溶液反应生成盐L,也能与Z的水溶液反应生成盐;丙、戊可组成化合物M.
甲、乙、丙、丁、戊为原子序数依次增大的短周期元素.甲、丙处于同一主族,丙、丁、戊处于同一周期,戊原子的最外层电子数是甲、乙、丙原子最外层电子数之和.甲、乙组成的常见气体X能使湿润的红色石蕊试纸变蓝;戊的单质与X反应能生成乙的单质,同时生成两种溶于水均呈酸性的化合物Y和Z,0.1 mol/L的Y溶液pH>1;丁的单质既能与丙元素最高价氧化物的水化物的溶液反应生成盐L,也能与Z的水溶液反应生成盐;丙、戊可组成化合物M.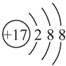 .
.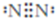 .
.