题目内容
5.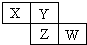 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )| A. | X的气态氢化物能与其最高价氧化物对应的水化物反应生成盐 | |
| B. | 原子半径:X<Y | |
| C. | Z的非金属性比Y的强 | |
| D. | X与Y形成的化合物都易溶于水 |
分析 X、Y、Z、W均为短周期元素,Y原子的最外层电子数是内层电子数的3倍,最外层最多含有8个电子,则Y原子有2个电子层,最外层含有6个电子,Y为O元素;根据X、Y、Z、W在周期表中相对位置可知,X为N元素,Z为S元素,W为Cl元素,据此结合元素周期律知识解答.
解答 解:X、Y、Z、W均为短周期元素,Y原子的最外层电子数是内层电子数的3倍,最外层最多含有8个电子,则Y原子有2个电子层,最外层含有6个电子,Y为O元素;根据X、Y、Z、W在周期表中相对位置可知,X为N元素,Z为S元素,W为Cl元素,
A.X为N元素,其气态氢化物为氨气,氮元素的最高价氧化物对应水合物为硝酸,氨气与硝酸反应生成硝酸铵,硝酸铵为铵盐,故A正确;
B.X、Y位于同一周期,原子序数越大,原子半径越小,则原子半径X>Y,故B错误;
C.Z、Y位于同一主族,原子序数越大,非金属性越弱,则Z的非金属性比Y弱,故C错误;
D.X、Y分别为N、O元素,二者形成的化合物中,NO难溶于水,故D错误;
故选A.
点评 本题考查了位置结构与性质的关系,题目难度不大,正确推断Y为解答关键,注意熟练掌握元素周期表结构、元素周期律内容,试题侧重基础知识的考查,有利于培养学生的分析能力及逻辑推理能力.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
15.下列说法正确的是(NA表示阿伏加德罗常数的值)( )
| A. | 1 mol聚乙烯含有的原子数目为6NA | |
| B. | 标准状况下1 L己烷完全燃烧后恢复至原状态,生成气态物质分子数为$\frac{5{N}_{A}}{22.4}$ | |
| C. | 1 mol甲基含10NA个电子 | |
| D. | 2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2NA |
13.进行化学实验时必须要有安全意识,下列做法错误的是( )
| A. | 被玻璃割伤手后,先取出伤口里的玻璃片,再用稀过氧化氢溶液擦洗,然后敷药包扎 | |
| B. | 制取蒸馏水时,为了防止瓶内产生暴沸现象,应向烧瓶内加入几片碎瓷片 | |
| C. | 温度计摔坏导致水银散落到地面上,应立即用水冲洗水银 | |
| D. | 滴瓶中的滴管用后不用清洗,直接放到原滴瓶中 |
20.在由氧化铜和氧化铁组成的a g混合物中,取其一半加入2mol•L-1的稀盐酸溶液50mL,固体恰好完全溶解;若将原混合物在过量的CO气流中加热充分反应,冷却后剩余固体的质量为( )
| A. | 1.6a g | B. | (a-1.6)g | C. | (a-3.2)g | D. | (2a-3.2)g |
10.下列有关物质的性质与其应用不相对应的是( )
| A. | Al具有良好延展性和抗腐蚀性,可制成铝箔包装物品 | |
| B. | 二氧化硅有良好的导电性,是制造光导纤维的主要材料 | |
| C. | 药皂中加入少量苯酚,可以起到杀菌消毒的作用 | |
| D. | 碳酸钠溶液显碱性,可用热的纯碱溶液除去金属器件表面的油污 |
15.已知下列热化学反应方程式:
①Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-25kJ•mol-1
②3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H=-47kJ•mol-1
③Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=19kJ•mol-1.
则FeO(s)被CO(g)还原成Fe(s)和CO2(g)的热化学方程式为( )
①Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-25kJ•mol-1
②3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H=-47kJ•mol-1
③Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=19kJ•mol-1.
则FeO(s)被CO(g)还原成Fe(s)和CO2(g)的热化学方程式为( )
| A. | FeO+CO═Fe+CO2 △H=-11kJ•mol-1 | |
| B. | FeO(s)+CO(g)═Fe(s)+CO2(g)△H=-22kJ•mol-1 | |
| C. | FeO(s)+CO(g)═Fe(s)+CO2(g)△H=-11kJ•mol-1 | |
| D. | FeO(s)+CO(g)═Fe(s)+CO2(g))△H=11kJ•mol-1 |