题目内容
4. 肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).
肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4•H2O+NaCl
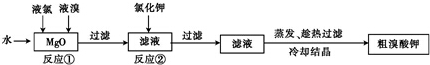
实验一:制备NaClO溶液
(1)将氯气通入到盛有NaOH的锥形瓶中,锥形瓶中发生反应的离子方程式是Cl2+2OH-=ClO-+Cl-+H2O;
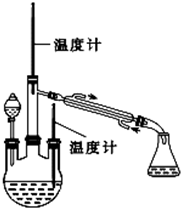
实验二:制取水合肼(实验装置如图所示)
控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应.加热蒸馏三颈烧瓶内的溶液,收集108~114℃馏分.(已知:N2H4•H2O+2NaClO=N2↑+3H2O+2NaCl)
(2)分液漏斗中的溶液是A(填标号A或B);
A.NaOH和NaClO混合溶液 B.CO (NH2) 2溶液
选择的理由是如果次氯酸钠溶液装在烧瓶中,反应生成的水合肼会被次氯酸钠氧化;
实验三:测定馏分中肼含量
水合肼具有还原性,可以生成氮气.测定水合肼的质量分数可采用下列步骤:
a.称取馏分5.000 g,加入适量NaHCO3固体,经稀释、转移、定容等步骤,配制250 mL溶液.
b.移取25.00 mL于锥形瓶中,加入10mL水,摇匀.
c.用0.2000 mol/L碘溶液滴定至溶液出现微黄色且半分钟内不消失,滴定过程中,溶液的pH保持在6.5左右.记录消耗碘的标准液的体积.
d.进一步操作与数据处理
(3)水合肼与碘溶液反应的化学方程式N2H4•H2O+2I2=N2↑+4HI+H2O;滴定过程中,NaHCO3能控制溶液的pH在6.5左右,原因是生成的HI与NaHCO3反应;
(4)滴定时,碘的标准溶液盛放在酸式滴定管中(选填:“酸式”或“碱式”);若本次滴定消耗碘的标准溶液为18.00 mL,馏分中水合肼(N2H4•H2O)的质量分数为18.0%(保留三位有效数字);
(5)为获得更可靠的滴定结果,步骤d中进一步操作主要是:重复步骤b和c2~3次,依据测得的结果,取平均值.
分析 (1)氯气通入到盛有NaOH的锥形瓶中发生反应生成氯化钠、次氯酸钠和水;
(2)依据制取水合肼(N2H4•H2O)的反应原理为:CO(NH2)+2NaOH+NaClO=Na2CO3+N2H4•H2O+NaCl,结合反应产物和反应物分析判断;水合肼(N2H4•H2O)具有还原性,易被次氯酸钠氧化;
(3)水合肼与碘溶液反应发生氧化还原反应,生成氮气、碘化氢和水;NaHCO3能控制溶液的pH在6.5左右,是因为碳酸氢钠和碘化氢反应;
(4)碘单质具有氧化性,选择酸式滴定管盛装进行实验;结合反应定量关系计算得到馏分中水合肼(N2H4•H2O)的质量分数;
(5)为获得更可靠的滴定结果,步骤d中进一步操作是重复bc几次,结合测定结果计算体积的平均值,得到结果更准确.
解答 解:(1)氯气通入到盛有NaOH的锥形瓶中发生反应生成氯化钠、次氯酸钠和水,反应的离子方程式为:Cl2+2OH-=ClO-+Cl-+H2O;
故答案为:Cl2+2OH-=ClO-+Cl-+H2O;
(2)依据制取水合肼(N2H4•H2O)的反应原理为:CO(NH2)+2NaOH+NaClO=Na2CO3+N2H4•H2O+NaCl,结合反应产物和反应物分析判断,分液漏斗中的溶液是NaOH和NaClO混合溶液;水合肼(N2H4•H2O)具有还原性,易被次氯酸钠氧化,如果次氯酸钠溶液装在烧瓶中,反应生成的水合肼会被次氯酸钠氧化;
故答案为:A,如果次氯酸钠溶液装在烧瓶中,反应生成的水合肼会被次氯酸钠氧化;
(3)水合肼与碘溶液反应发生氧化还原反应,生成氮气、碘化氢和水,反应的化学方程式为:N2H4•H2O+2I2=N2↑+4HI+H2O;NaHCO3能控制溶液的pH在6.5左右,是因为碳酸氢钠和碘化氢反应;
故答案为:N2H4•H2O+2I2=N2↑+4HI+H2O,生成的HI与NaHCO3 反应;
(4)碘单质具有氧化性,选择酸式滴定管盛装进行实验;结合反应定量关系计算得到馏分中水合肼(N2H4•H2O)的质量分数,
N2H4•H2O+2I2=N2↑+4HI+H2O;
1 2
n 0.2000mol/L×0.018L
n=0.0018mol
250ml溶液中含有的物质的量=0.0018mol×$\frac{250}{25}$=0.018mol
水合肼(N2H4•H2O)的质量分数=$\frac{0.018mol×50g/mol}{5.00g}$×100%=18.0%
故答案为:酸式,18.0%;
(5)为获得更可靠的滴定结果,步骤d中进一步操作是重复bc几次,结合测定结果计算体积的平均值,得到结果更准确;
故答案为:重复步骤b和c 2~3次,依据测得的结果,取平均值.
点评 本题考查了物质制备和性质的实验分析和验证方法应用,主要是过程分析判断,掌握基础是关键,题目难度中等.

| A. | 侯氏制碱法的基本原理:Na++NH3+H2O+CO2=NaHCO3↓+NH4+ | |
| B. | 向KAl(SO4)2溶液中加入Ba(OH)2溶液至中性:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ | |
| C. | 硫酸亚铁溶液中滴加酸化的双氧水:2Fe2++2H++H2O2=2Fe3++2H2O | |
| D. | 向漂白粉溶液中通入少量的SO2气体:Ca2++2ClO-+H2O+SO2=CaSO3↓+2HClO |
| A. | Si→SiO2→H2SiO3→Na2SiO3 | B. | Na→Na2O2→Na2CO3→NaCl | ||
| C. | Fe→FeCl3→Fe(OH)3→Fe2O3 | D. | Al→Al2O3→AlCl3→Al(OH)3 |
| A. | 酸性:HClO4>H3PO4>H2SiO3 | B. | 还原性:Na>Mg>Al | ||
| C. | 稳定性:HF>HCl>HBr | D. | 原子半径:Cl>S>O |
| A. | X的氢化物溶于水显酸性 | |
| B. | Z的氧化物的水化物一定是强酸 | |
| C. | Y的氧化物是离子化合物 | |
| D. | X和Z的最高价氧化物对应的水化物都是弱酸 |
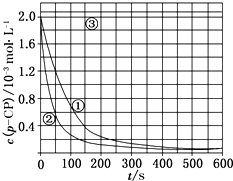 Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比实验.
(1)请完成以下实验设计表中横线上的内容.
| 实验编号 | 实验目的 | T/K | pH | c/10-3 mol•L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参照 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | 313 | |||
| ③ | 探究溶液的pH对降解反应速率的影响 | 298 | 10 | 6.0 | 0.30 |
(2)根据如图实验①曲线,计算降解反应50~150s内的反应速率:v(p-CP)=8.0×10-6mol•L-1•s-1. (3)实验①、②表明温度升高,降解反应速率增大.但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:H2O2在温度过高时迅速分解.
(4)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来.根据上图中的信息,给出一种迅速停止反应的方法:在溶液中加入碱溶液,使溶液的pH大于或等于10.
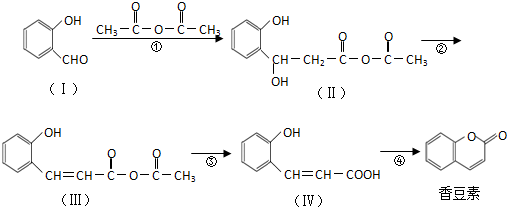
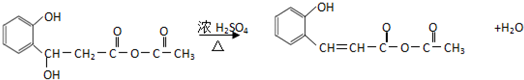 .
.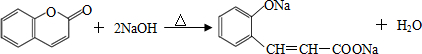 .
. (任意2种)(任写两种).
(任意2种)(任写两种).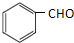 与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为
与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为 .
.