题目内容
15.下列各组物质的转化关系中,不全部是通过一步反应完成的是( )| A. | Si→SiO2→H2SiO3→Na2SiO3 | B. | Na→Na2O2→Na2CO3→NaCl | ||
| C. | Fe→FeCl3→Fe(OH)3→Fe2O3 | D. | Al→Al2O3→AlCl3→Al(OH)3 |
分析 A.SiO2→H2SiO3不能一步转化;
B.钠在氧气中点燃生成过氧化钠,过氧化钠与二氧化碳反应生成碳酸钠,碳酸钠与盐酸反应生成氯化钠;
C.铁在氯气中点燃生成氯化铁,氯化铁与氢氧化钠反应生成氢氧化铁,灼烧氢氧化铁得到三氧化二铁;
D.铝与氧气反应生成三氧化二铝,三氧化二铝与盐酸反应生成氯化铝,氯化铝与氢氧化钠反应生成氢氧化铝.
解答 解:A.SiO2→H2SiO3不能一步转化,符合题意,故A正确;
B.Na→Na2O2→Na2CO3→NaCl,反应方程式分别是:2Na+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2O2、2Na2O2+2CO2=2Na2CO3+CO2、Na2CO3+2HCl=2NaCl+CO2↑+H2O,故B错误;
C.Fe→FeCl3→Fe(OH)3→Fe2O3 ,反应方程式分别是:2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3、FeCl3+3NaOH=Fe(OH)3↓+3NaCl、2Fe(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+3H2O,故C错误;
D.Al→Al2O3→AlCl3→Al(OH)3,反应方程式分别是:4Al+3O2$\frac{\underline{\;\;△\;\;}}{\;}$2Al2O3、Al2O3+6HCl=2AlCl3+3H2O、AlCl3+3NaOH=Al(OH)3↓+3NaCl,故D错误;
故选A.
点评 本题考查物质之间的转化,侧重元素化合物性质的考查,把握常见物质硅、钠、铁、铝及其化合物的性质为解答的关键,注意一步转化,题目难度不大.

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目
6.25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A. | 0.1 mol•L-1 CH3COONa溶液与0.1 mol•L-1HCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-) | |
| B. | 0.1 mol•L-1 NH4Cl溶液与0.1 mol•L-1氨水等体积混合(pH>7):c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) | |
| C. | 0.1 mol•L-1Na2CO3溶液与0.1 mol•L-1NaHCO3溶液等体积混合:$\frac{3}{2}$c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | 0.1 mol•L-1Na2C2O4溶液与0.1 mol•L-1HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O42-)+c(OH-)=c(Na+)+c(H+) |
3.若把周期表原先的主、副族号取消,由左到右按原顺序编为18纵行.如碱金属为第1纵行,稀有气体为第18纵行,按这个规定,下列说法不正确的是( )
| A. | 计算机芯片的组成元素位于第14纵行 | |
| B. | 第10纵行元素全部是金属元素 | |
| C. | 第3纵行元素的种类最多 | |
| D. | 只有第2纵行元素的原子最外层有2个电子 |
10.原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关.已知常温下,有下列3个装置.下列说法中正确的是( )
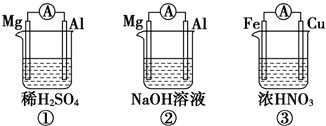

| A. | ①②中Mg作负极,③中Fe作负极 | |
| B. | ②中Al作正极,其电极反应式为Al-3e-=Al3+ | |
| C. | ③中Fe作负极,电极反应式为Fe-2e-=Fe2+ | |
| D. | 若①②中转移的电子数相同,则①②中产生的H2的量也一定相同 |
20.假酒引起中毒的主要成分是( )
| A. | 甲醇 | B. | 乙醇 | C. | 甲醛 | D. | 乙酸乙酯 |
7.生活中处处有化学,下列表述不正确的是( )
| A. | 食醋的主要成分是醋酸,它是一种弱酸 | |
| B. | 苯酚有毒,但可用于杀菌消毒 | |
| C. | 聚乙烯塑料制品可用于食品的包装 | |
| D. | 福尔马林可作食品的保鲜剂 |
5.下列说法正确的是( )
| A. | 盐酸的导电能力一定大于醋酸 | |
| B. | 在氨水中加入无水醋酸,溶液的导电能力基本不变 | |
| C. | 在氢氧化钡的稀溶液中,c(OH-)=2c(Ba2+) | |
| D. | 在磷酸的稀溶液中,c(H+)=3c(PO43-) |
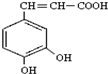 )也叫3,4-二羟基桂皮酸,它存在于许多种药中,如野胡萝卜、光叶水苏、荞麦、木半夏等.咖啡酸有止血作用,对内脏的止血效果较好,毒性较小,还有镇咳、祛痰等疗效.
)也叫3,4-二羟基桂皮酸,它存在于许多种药中,如野胡萝卜、光叶水苏、荞麦、木半夏等.咖啡酸有止血作用,对内脏的止血效果较好,毒性较小,还有镇咳、祛痰等疗效. .写出咖啡酸与NaHCO3溶液反应的方程式::
.写出咖啡酸与NaHCO3溶液反应的方程式::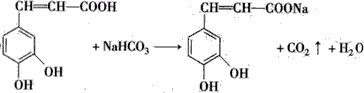 .
.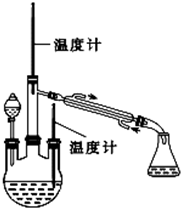 肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).
肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).