题目内容

(1)该硫酸的物质的量浓度是________mol/L。
(2)某化学兴趣小组进行硫酸性质的实验探究时,需要490 mL 4.6 mol/L的稀硫酸,则需要取________mL的该硫酸。
(3)配制时,所需的玻璃仪器除量筒、烧杯、玻璃棒和胶头滴管之外,还需要 (填仪器名称);
(4)配制溶液有如下(未按顺序排列):a.溶解,b.摇匀,c.洗涤,d.冷却,e.称量,f.将溶液移至容量瓶,g.定容等操作。 其中摇匀的前一步操作是 ;(填写字母)
(5)在下列配制过程示意图中,有错误的是(填写序号) 。

(6)在配制4.6 mol/L的稀硫酸的过程中,下列情况会引起硫酸溶液物质的量浓度偏高的是_________
A.未经冷却趁热将溶液注入容量瓶中 | B.容量瓶洗涤后,未经干燥处理 |
C.定容时仰视观察液面 | D.未洗涤烧杯和玻璃棒 |
练习册系列答案
相关题目
16.将下列各组物质按酸、碱、盐分类顺序排列,其中正确的是( )
| A. | 硫酸、纯碱、漂白粉 | B. | 硫酸、烧碱、小苏打 | ||
| C. | 硫酸氢钠、生石灰、醋酸钠 | D. | 磷酸、熟石灰、苛性钠 |
1.25℃时氯水含Cl2、HClO和ClO-组份φ%(以物质的量计算)分布图如下,下列结论正确的是( )

| A. | n(Cl2)、n(HClO)和n(ClO-)之和不随pH变化而变化 | |
| B. | 当pH逐渐增大时,HClO先增大后减小 | |
| C. | 当pH>8.5时,c(H+)=c(OH-)+c(ClO-)+c(Cl-) | |
| D. | K1、K2均是通过曲线交点计算得出的酸的电离平衡常数 |


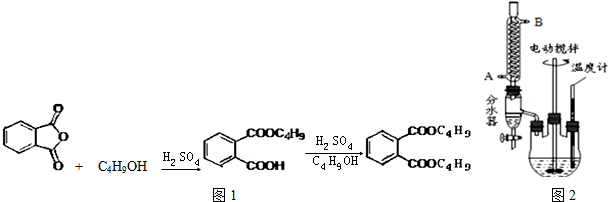
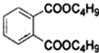 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$ +2CH3CH2CH2CH2OH.
+2CH3CH2CH2CH2OH.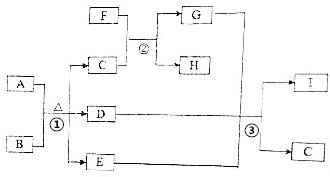 有关物质的转化关系如图所示(部分生成物与反应条件己略去).A是常见的非金属固体单质,F是紫红色的金属单质,B、C是常见的强酸,D、G、I是常见的气体,D与I的组成元素相同,且D的相对分子质量比I的大16.E是最常见的无色液体.请回答下列问题:
有关物质的转化关系如图所示(部分生成物与反应条件己略去).A是常见的非金属固体单质,F是紫红色的金属单质,B、C是常见的强酸,D、G、I是常见的气体,D与I的组成元素相同,且D的相对分子质量比I的大16.E是最常见的无色液体.请回答下列问题: .
. 10—9m~10—7m范围内,对原子、分子进行操纵的纳米超分子技术往往能实现意想不到的变化。纳米铜粒一遇到空气就会剧烈燃烧,甚至发生爆炸。下列说法正确的是
10—9m~10—7m范围内,对原子、分子进行操纵的纳米超分子技术往往能实现意想不到的变化。纳米铜粒一遇到空气就会剧烈燃烧,甚至发生爆炸。下列说法正确的是 )
) 2C(g)。2 s内的反应速率:v(A2)=0.5 mol·L-1·s-1,v(B2)=1.5 mol·L-1·s-1,v(C)=1 mol·L-1·s-1。则x和y的值分别为
2C(g)。2 s内的反应速率:v(A2)=0.5 mol·L-1·s-1,v(B2)=1.5 mol·L-1·s-1,v(C)=1 mol·L-1·s-1。则x和y的值分别为