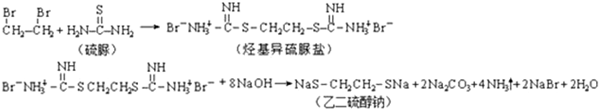
题目内容
14.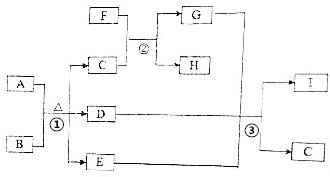 有关物质的转化关系如图所示(部分生成物与反应条件己略去).A是常见的非金属固体单质,F是紫红色的金属单质,B、C是常见的强酸,D、G、I是常见的气体,D与I的组成元素相同,且D的相对分子质量比I的大16.E是最常见的无色液体.请回答下列问题:
有关物质的转化关系如图所示(部分生成物与反应条件己略去).A是常见的非金属固体单质,F是紫红色的金属单质,B、C是常见的强酸,D、G、I是常见的气体,D与I的组成元素相同,且D的相对分子质量比I的大16.E是最常见的无色液体.请回答下列问题:(1)E的电子式为
 .
.(2)H的化学式为CuSO4.
(3)写出反应①的化学方程式:S+6HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$H2SO4+6NO2↑+2H2O.
(4)写出反应②的离子方程式:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++SO42-+SO2↑+2H2O.
写出反应③的离子方程式:NO2+SO2+H2O=2H++SO42-+NO.
分析 F是紫红色的金属单质,则F为Cu;B、C是常见的强酸,非金属固体单质与B反应得到C,且C能与Cu反应,可知A为S,B为HNO3,C为H2SO4,E为H2O,而G、D、E反应得到C,D的相对分子质量比I的大16,则D为NO2,G为SO2,I为NO,H为CuSO4,符合转化关系,据此解答.
解答 解:F是紫红色的金属单质,则F为Cu;B、C是常见的强酸,非金属固体单质与B反应得到C,且C能与Cu反应,可知A为S,B为HNO3,C为H2SO4,E为H2O,而G、D、E反应得到C,D的相对分子质量比I的大16,则D为NO2,G为SO2,I为NO,H为CuSO4,符合转化关系.
(1)E为H2O,电子式为 ,故答案为:
,故答案为: ;
;
(2)H的化学式为:CuSO4,故答案为:CuSO4;
(3)反应①的化学方程式:S+6HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$H2SO4+6NO2↑+2H2O,
故答案为:S+6HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$H2SO4+6NO2↑+2H2O;
(4)反应②的离子方程式:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++SO42-+SO2↑+2H2O,
反应③的离子方程式:NO2+SO2+H2O=2H++SO42-+NO,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++SO42-+SO2↑+2H2O;NO2+SO2+H2O=2H++SO42-+NO.
点评 本题考查无机物推断,B、C为强酸为推断突破口,需要学生熟练掌握元素化合物性质,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
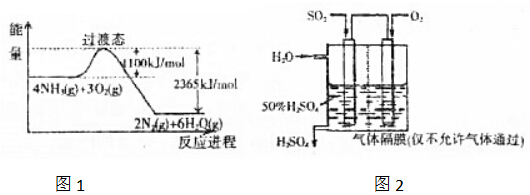
小学生10分钟应用题系列答案| A. | 360 kJ/mol | B. | 263 kJ/mol | C. | 1 173 kJ/mol | D. | 391 kJ/mol |
| A. | 完全燃烧生成二氧化碳和水的化合物不一定是烃 | |
| B. | 相同质量的正丁烷和异丁烷分别完全燃烧,耗氧量相等 | |
| C. | 相同物质的量乙烯和乙醇分别完全燃烧,耗氧量相等 | |
| D. | 相同质量的乙烷和乙炔分别完全燃烧,耗氧量相等 |

(1)该硫酸的物质的量浓度是________mol/L。
(2)某化学兴趣小组进行硫酸性质的实验探究时,需要490 mL 4.6 mol/L的稀硫酸,则需要取________mL的该硫酸。
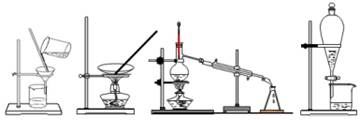
(3)配制时,所需的玻璃仪器除量筒、烧杯、玻璃棒和胶头滴管之外,还需要 (填仪器名称);
(4)配制溶液有如下(未按顺序排列):a.溶解,b.摇匀,c.洗涤,d.冷却,e.称量,f.将溶液移至容量瓶,g.定容等操作。 其中摇匀的前一步操作是 ;(填写字母)
(5)在下列配制过程示意图中,有错误的是(填写序号) 。

(6)在配制4.6 mol/L的稀硫酸的过程中,下列情况会引起硫酸溶液物质的量浓度偏高的是_________
A.未经冷却趁热将溶液注入容量瓶中 | B.容量瓶洗涤后,未经干燥处理 |
C.定容时仰视观察液面 | D.未洗涤烧杯和玻璃棒 |