题目内容
16.将下列各组物质按酸、碱、盐分类顺序排列,其中正确的是( )| A. | 硫酸、纯碱、漂白粉 | B. | 硫酸、烧碱、小苏打 | ||
| C. | 硫酸氢钠、生石灰、醋酸钠 | D. | 磷酸、熟石灰、苛性钠 |
分析 酸是指电离时生成的阳离子全部是氢离子的化合物,
碱是指电离时生成的阴离子全部是氢氧根离子的化合物,
盐是指由金属离子和酸根离子组成的化合物.
解答 解:A、硫酸属于酸,纯碱是碳酸钠属于盐,漂白粉是氯化钙和次氯酸钙的混合物,故A错误;
B、硫酸属于酸,烧碱是氢氧化钠属于碱,小苏打是碳酸氢钠的俗称,属于盐,故B正确;
C、硫酸氢钠、生石灰、醋酸钠分别属于盐、氧化物和盐,故C错误;
D、磷酸属于酸,熟石灰是氢氧化钙属于碱,苛性钠是氢氧化钠俗称,属于碱,故D错误.
故选B.
点评 本题考查了物质组成、物质分类,解答本题要充分理解酸碱盐的概念的含义,只有这样才能对各种物质进行正确的分类,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.把铝粉和某铁的氧化物(xFeO•yFe2O3)粉末配成铝热剂,分成两等份.一份在高温下恰好完全反应后,再与足量盐酸反应;另一份直接放入足量的烧碱溶液中充分反应.前后两种情况下生成的气体质量比是5:7,则x:y为( )
| A. | 1:1 | B. | 1:2 | C. | 5:7 | D. | 7:5 |
1.配制一定物质的量浓度的NaOH溶液时,能造成所配溶液浓度偏低的原因是( )
| A. | 定容时俯视液面 | B. | 未洗涤烧杯和玻璃棒 | ||
| C. | 容量瓶未干燥 | D. | 转移溶液前溶液未冷却至室温 |
5.由N2 和H2 合成1 mol NH3 时可放出46 kJ 的热量,从手册上查出N≡N 键的键能是946 kJ/mol,H-H 键的键能是436 kJ/mol,则N-H 键的键能是( )
| A. | 360 kJ/mol | B. | 263 kJ/mol | C. | 1 173 kJ/mol | D. | 391 kJ/mol |

(1)该硫酸的物质的量浓度是________mol/L。
(2)某化学兴趣小组进行硫酸性质的实验探究时,需要490 mL 4.6 mol/L的稀硫酸,则需要取________mL的该硫酸。
(3)配制时,所需的玻璃仪器除量筒、烧杯、玻璃棒和胶头滴管之外,还需要 (填仪器名称);
(4)配制溶液有如下(未按顺序排列):a.溶解,b.摇匀,c.洗涤,d.冷却,e.称量,f.将溶液移至容量瓶,g.定容等操作。 其中摇匀的前一步操作是 ;(填写字母)
(5)在下列配制过程示意图中,有错误的是(填写序号) 。

(6)在配制4.6 mol/L的稀硫酸的过程中,下列情况会引起硫酸溶液物质的量浓度偏高的是_________
A.未经冷却趁热将溶液注入容量瓶中 | B.容量瓶洗涤后,未经干燥处理 |
C.定容时仰视观察液面 | D.未洗涤烧杯和玻璃棒 |

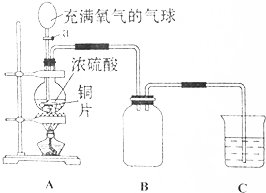 小明同学设计了如图所示装置探究铜跟浓硫酸的反应.先关闭活塞a,加热至烧瓶中不再有气泡产生时,反应停止,此时烧瓶中铜片仍有剩余.接着再打开活塞a,将气球中的氧气缓缓挤入烧瓶,铜片慢慢减少.
小明同学设计了如图所示装置探究铜跟浓硫酸的反应.先关闭活塞a,加热至烧瓶中不再有气泡产生时,反应停止,此时烧瓶中铜片仍有剩余.接着再打开活塞a,将气球中的氧气缓缓挤入烧瓶,铜片慢慢减少.