题目内容
1.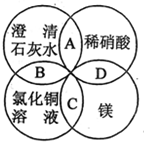 镁、稀硝酸、澄清石灰水、氯化铜溶液是中学化学中的常见物质,四种物质间的反应关系如图所示.图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应反应的离子方程式书写正确的是( )
镁、稀硝酸、澄清石灰水、氯化铜溶液是中学化学中的常见物质,四种物质间的反应关系如图所示.图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应反应的离子方程式书写正确的是( )| A. | OH-+HNO3═H2O+NO3- | B. | Ca(OH)2+Cu2+═Ca2++Cu(OH)2 | ||
| C. | Mg+Cu2+═Cu+Mg2+ | D. | Mg+2H+=Mg2++H2↑ |
分析 离子方程式的常见错误有:反应原理错误、化学式拆分错误、前后离子电荷不守恒、前后元素的原子个数不守恒等,据此此进行逐一检查.
A、硝酸是强电解质;
B、氢氧化钙溶液中氢氧化钙完全电离;
C、镁金属性大于铜,可以置换铜发生置换反应;
D、硝酸具有强氧化性,镁和硝酸反应生成硝酸镁、一氧化氮和水.
解答 解:A、稀硝酸和石灰水发生中和反应,反应的离子方程式应为:H++OH-=H2O,故A错误;
B、氯化铜和石灰水反应生成氢氧化铜沉淀,反应的离子方程式应为:Cu2++2OH-=Cu(OH)2↓,故B错误;
C、镁与氯化铜溶液发生置换反应,生成氯化镁和铜,反应的离子方程式为:Mg+Cu2+=Mg2++Cu,故C正确;
D、镁为活泼金属,与稀硝酸不能发生置换反应生成氢气,反应的离子方程式为3Mg+2NO3-+8H+=2Mg2++2NO↑+4H2O,故D错误;
故选C.
点评 本题难度不大,离子方程式的书写及正误判断是一个常考点,也是重点,平时必须总结常见的错误,并加以强化训练,题目较简单.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11.已知:Na2O2+CO2→Na2CO3+O2(未配平),关于该反应的说法中正确的是( )
| A. | 生成0.1 mol O2转移0.4mol电子 | |
| B. | 相同条件下足量Na2O2吸收10LCO2放出5LCO2 | |
| C. | 氧化剂是Na2O2,还原剂是CO2 | |
| D. | 在Na2O2+SO2═Na2SO4的反应中,SO2的作用跟CO2相同 |
12.鉴别苯酚溶液、己烷、己烯、乙酸溶液和乙醇液体,可选用的最佳试剂是( )
| A. | 溴水、Cu(OH)2 | B. | FeCl3溶液、金属钠、溴水、石蕊试液 | ||
| C. | 石蕊试液、溴水 | D. | KMnO4酸性溶液、石蕊试液 |
9.下列溶液中能大量共存的一组离子是( )
| A. | Ba2+、K+、Na+、SO42- | B. | Na+、H+、OH-、Cl- | ||
| C. | Mg2+、K+、Cl-、NO3- | D. | Ca2+、K+、CO32-、SO42- |
16.NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 1 LO.l mol•L-1 NH4NO3溶液中的氮原子数为0.1NA | |
| B. | 22g N2O所含有的分子数为0.5NA | |
| C. | 11.2LCO2所含有的分子数为0.5NA | |
| D. | 将足量铜加入54.3mL 18.4 mol•L-1浓H2S04中充分反应产生气体的分子数为0.5NA |
6.下来气体有颜色的是( )
| A. | Cl2 | B. | O2 | C. | NO | D. | CO |
10.对于某些常见物质的检验及结论一定正确的是( )
| A. | 加稀盐酸产生无色气体,将气体通过澄清石灰水中,溶液变浊,一定有SO32- | |
| B. | 加氯化钡溶液有白色沉淀产生,再加盐酸沉淀不消失,一定有SO42- | |
| C. | 加氢氧化钠并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ | |
| D. | 某溶液焰色反应为黄色,则待测液中一定不含钾元素 |
11.在一定条件下,对于在密封容器中进行的反应:P(g)+Q(g)?R(g)+S(g),下列情况已经达到化学平衡状态的是( )
| A. | P、Q、R、S的浓度相等 | B. | P、Q、R、S在密闭容器中共存 | ||
| C. | P、Q、R、S的浓度不再变化 | D. | 容器内的压强不再变化 |