题目内容
11.已知:Na2O2+CO2→Na2CO3+O2(未配平),关于该反应的说法中正确的是( )| A. | 生成0.1 mol O2转移0.4mol电子 | |
| B. | 相同条件下足量Na2O2吸收10LCO2放出5LCO2 | |
| C. | 氧化剂是Na2O2,还原剂是CO2 | |
| D. | 在Na2O2+SO2═Na2SO4的反应中,SO2的作用跟CO2相同 |
分析 该反应中,O元素化合价由-价变为-2价和0价,所以过氧化钠既是氧化剂又是还原剂,以此来解答.
解答 解:A、生成0.1 mol O2转移0.1mol电子,故A错误;
B、由反应方程式可知2Na2O2+2CO2=2Na2CO3+O2,吸收10LCO2放出5LCO2,故B正确;
C、氧化剂是Na2O2,还原剂是Na2O2,故C错误;
D、在Na2O2+SO2═Na2SO4的反应中,二氧化硫具有还原性,所以SO2的作用跟CO2不同,故D错误;
故选B.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目
1.下表是周期表中的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答下列问题:
(1)C的离子结构示意图为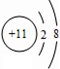 ,I的原子结构示意图
,I的原子结构示意图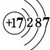 .
.
(2)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为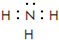 ;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).
;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).
(3)元素的最高价氧化物对应的水化物中,碱性最强的是NaOH,该碱化学键类型离子键和共价键,酸性最强的是HClO4,呈两性的是Al(OH)3.
(4)A分别与D、E、F、G H形成的化合物的稳定性顺序为:CH4<NH3<H2O<HF.
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | B | ||||||
| 2 | D | E | F | G | ||||
| 3 | C | H | I |
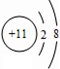 ,I的原子结构示意图
,I的原子结构示意图 .
.(2)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为
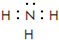 ;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).
;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).(3)元素的最高价氧化物对应的水化物中,碱性最强的是NaOH,该碱化学键类型离子键和共价键,酸性最强的是HClO4,呈两性的是Al(OH)3.
(4)A分别与D、E、F、G H形成的化合物的稳定性顺序为:CH4<NH3<H2O<HF.
19.在某稀溶液中含4mol KNO3和2.5mol H2SO4,向其中加入1.5mol Fe粉,充分反应(已知NO3-被还原为NO).下列说法正确的是( )
| A. | 所得溶液中C(Fe2+):C(Fe3+)=1:1 | B. | 所得溶液中C(NO3-)=2.75mol/L | ||
| C. | 反应后生成NO的体积为28 L | D. | 所得溶液中溶质只有FeSO4和K2SO4 |
6.下列说法正确的是( )
| A. | 22.4L N2的物质的量为1mol | |
| B. | 标准状况下,1mol任何物质的体积为22.4L | |
| C. | SO2的摩尔质量与相对分子质量相等 | |
| D. | 在相同温度、压强下,相同体积的任何气体分子数相同 |
16.向蔗糖中加入浓硫酸,现象如图所示.关于该实验的说法中不正确的是( )


| A. | 蔗糖变黑体现了浓硫酸的脱水性 | |
| B. | 蔗糖体积膨胀变成疏松多孔的海绵状物质炭 | |
| C. | 实验中有大量气体产生体现了浓硫酸的强酸性 | |
| D. | 将产生的气体通入品红溶液,溶液会褪色 |
20. 2015年8月12日天津港发生了危化品特大爆炸事故,爆炸仓库存有大量氰化钠(NaCN)、硝酸铵、四氯化钛等物品.
2015年8月12日天津港发生了危化品特大爆炸事故,爆炸仓库存有大量氰化钠(NaCN)、硝酸铵、四氯化钛等物品.
(1)NaCN溶液中各离子浓度大小关系为c(Na+)>c(CN-)>c(OH-)>c(H+).
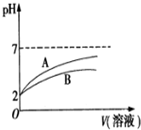
已知NaCN遇酸能产生HCN;25℃时,HCN的电离常数Ka=6.2×10-10 mol•L-1;CH3COOH的电离常数Ka=1.7×10-5 mol•L-1.体积均为100mL、pH=2的CH3COOH溶液和HCN溶液,加水稀释过程中溶液的pH变化与溶液体积的关系如图所示,则表示CH3COOH溶的pH变化趋势的曲线是A(选填“A”或“B”);相同条件下,NaCN溶液的pH>(选填“>”、“=”或“<”)CH3COONa溶液的pH.
(2)200℃固体硝酸铵可以分解为N2O和H2O,此过程中每转移电子8mol放出热量84.8kJ,写出此反应的热化学方程式NH4NO3(s)=N2O(g)+2H2O(g)△H=-42.4 kJ•mol-1.
(3)工业上用氯气和二氧化钛制备TiCl4,一定条件下发生反应:
TiO2(s)+2Cl2(g)═TiCl4(g)+O2(g);△H>0.此温度下,该反应的平衡常数为400,在密闭容器中加入TiO2(s)和Cl2(g),反应到t时刻测得各组分的浓度如表所示:
①根据表中数据判断t时刻此反应向正反应方向进行(选填“正”或“逆”).
②若经10min反应达到平衡,则该时间内反应速率v(Cl2)=0.16mol•L-1•min-1;下列措施中,可以使平衡向右移动的是d(选填序号).
a.使用催化剂b.增大压强c.减小压强d.升高温度.
 2015年8月12日天津港发生了危化品特大爆炸事故,爆炸仓库存有大量氰化钠(NaCN)、硝酸铵、四氯化钛等物品.
2015年8月12日天津港发生了危化品特大爆炸事故,爆炸仓库存有大量氰化钠(NaCN)、硝酸铵、四氯化钛等物品.(1)NaCN溶液中各离子浓度大小关系为c(Na+)>c(CN-)>c(OH-)>c(H+).
已知NaCN遇酸能产生HCN;25℃时,HCN的电离常数Ka=6.2×10-10 mol•L-1;CH3COOH的电离常数Ka=1.7×10-5 mol•L-1.体积均为100mL、pH=2的CH3COOH溶液和HCN溶液,加水稀释过程中溶液的pH变化与溶液体积的关系如图所示,则表示CH3COOH溶的pH变化趋势的曲线是A(选填“A”或“B”);相同条件下,NaCN溶液的pH>(选填“>”、“=”或“<”)CH3COONa溶液的pH.
(2)200℃固体硝酸铵可以分解为N2O和H2O,此过程中每转移电子8mol放出热量84.8kJ,写出此反应的热化学方程式NH4NO3(s)=N2O(g)+2H2O(g)△H=-42.4 kJ•mol-1.
(3)工业上用氯气和二氧化钛制备TiCl4,一定条件下发生反应:
TiO2(s)+2Cl2(g)═TiCl4(g)+O2(g);△H>0.此温度下,该反应的平衡常数为400,在密闭容器中加入TiO2(s)和Cl2(g),反应到t时刻测得各组分的浓度如表所示:
| 物质 | Cl2 | TiCl4 | O2 |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
②若经10min反应达到平衡,则该时间内反应速率v(Cl2)=0.16mol•L-1•min-1;下列措施中,可以使平衡向右移动的是d(选填序号).
a.使用催化剂b.增大压强c.减小压强d.升高温度.
1.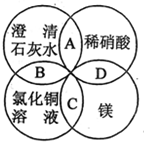 镁、稀硝酸、澄清石灰水、氯化铜溶液是中学化学中的常见物质,四种物质间的反应关系如图所示.图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应反应的离子方程式书写正确的是( )
镁、稀硝酸、澄清石灰水、氯化铜溶液是中学化学中的常见物质,四种物质间的反应关系如图所示.图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应反应的离子方程式书写正确的是( )
 镁、稀硝酸、澄清石灰水、氯化铜溶液是中学化学中的常见物质,四种物质间的反应关系如图所示.图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应反应的离子方程式书写正确的是( )
镁、稀硝酸、澄清石灰水、氯化铜溶液是中学化学中的常见物质,四种物质间的反应关系如图所示.图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应反应的离子方程式书写正确的是( )| A. | OH-+HNO3═H2O+NO3- | B. | Ca(OH)2+Cu2+═Ca2++Cu(OH)2 | ||
| C. | Mg+Cu2+═Cu+Mg2+ | D. | Mg+2H+=Mg2++H2↑ |
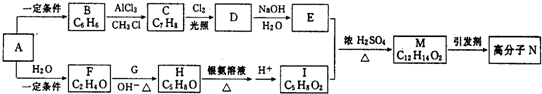
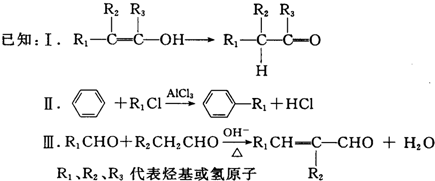
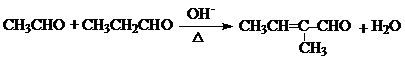 .
.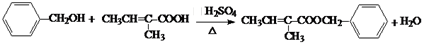 .
.