题目内容
16.NA表示阿伏加德罗常数的值,下列说法中正确的是( )| A. | 1 LO.l mol•L-1 NH4NO3溶液中的氮原子数为0.1NA | |
| B. | 22g N2O所含有的分子数为0.5NA | |
| C. | 11.2LCO2所含有的分子数为0.5NA | |
| D. | 将足量铜加入54.3mL 18.4 mol•L-1浓H2S04中充分反应产生气体的分子数为0.5NA |
分析 A.1mol硝酸铵含有2mol氮原子;
B.依据N=$\frac{m}{M}$×NA计算解答;
C.气体状态未知,无法确定Vm;
D.铜与浓硫酸反应,与稀硫酸不反应.
解答 解:A.1 LO.l mol•L-1 NH4NO3溶液,含有氮原子物质的量为0.2mol,氮原子数为0.2NA,故A错误;
B.22g N2O所含有的分子数为$\frac{22g}{44g/mol}$×NA=0.5NA,故B正确;
C.气体状态未知,无法确定Vm,无法计算二氧化碳的物质的量和分子数,故C错误;
D.将足量铜加入54.3mL 18.4 mol•L-1浓H2S04中,若浓硫酸完全反应生成0.5mol二氧化硫,但是随着反应进行浓硫酸浓度降低变为稀硫酸,稀硫酸与铜不反应,所以生成的气体的分子数小于0.5NA,故D错误;
故选:B.
点评 本题考查了阿伏伽德罗常数的应用,主要考查气体摩尔体积的条件应用,质量换算物质的量计算微粒数,关键是浓硫酸随着反应变稀后不与铜反应.

练习册系列答案
相关题目
6.下列说法正确的是( )
| A. | 22.4L N2的物质的量为1mol | |
| B. | 标准状况下,1mol任何物质的体积为22.4L | |
| C. | SO2的摩尔质量与相对分子质量相等 | |
| D. | 在相同温度、压强下,相同体积的任何气体分子数相同 |
4.下列各组物质不属于同素异形体的是( )
| A. | CO、CO2 | B. | O2、O3 | C. | 红磷、白磷 | D. | 金刚石、石墨 |
11.下列说法不正确的是( )
| A. | 实验室用Ca(OH)2固体和NH4Cl固体共热制NH3 | |
| B. | 常温下铁遇浓硝酸钝化,常温下可用铁罐储存浓硝酸 | |
| C. | 向蔗糖中滴入浓硫酸后变黑,体现了浓硫酸的脱水性 | |
| D. | FeCl2溶液中滴入KSCN溶液,溶液变红 |
1.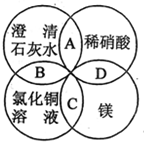 镁、稀硝酸、澄清石灰水、氯化铜溶液是中学化学中的常见物质,四种物质间的反应关系如图所示.图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应反应的离子方程式书写正确的是( )
镁、稀硝酸、澄清石灰水、氯化铜溶液是中学化学中的常见物质,四种物质间的反应关系如图所示.图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应反应的离子方程式书写正确的是( )
 镁、稀硝酸、澄清石灰水、氯化铜溶液是中学化学中的常见物质,四种物质间的反应关系如图所示.图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应反应的离子方程式书写正确的是( )
镁、稀硝酸、澄清石灰水、氯化铜溶液是中学化学中的常见物质,四种物质间的反应关系如图所示.图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应反应的离子方程式书写正确的是( )| A. | OH-+HNO3═H2O+NO3- | B. | Ca(OH)2+Cu2+═Ca2++Cu(OH)2 | ||
| C. | Mg+Cu2+═Cu+Mg2+ | D. | Mg+2H+=Mg2++H2↑ |
8.如图所示是分离混合物时常用的仪器,从左到右,可以进行的混合物分离操作方便是( )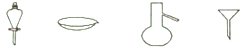
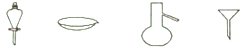
| A. | 蒸馏、蒸发、萃取、过滤 | B. | 蒸馏、过滤、萃取、蒸发 | ||
| C. | 过滤、蒸发、萃取、蒸馏 | D. | 萃取、蒸发、蒸馏、过滤 |
5.下列有关的化学史实描述错误的是( )
| A. | 中国化学家侯德榜研究了“侯氏联合制碱法”,为我国化工发展做出贡献 | |
| B. | 瑞典化学家舍勒发现软锰矿(含MnO2)与浓盐酸混合加热制得氯气 | |
| C. | 意大利物理甲阿伏伽德罗发现当光束通过胶体时可见一条光路 | |
| D. | 德国化学家哈伯在合成氨的研究中做出了巨大贡献 |
 为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应.乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊,推测在制得的乙炔中还可能含有少量还原性的杂质气体,由此他提出必须先除去,再与溴水反应.请你回答下列问题:
为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应.乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊,推测在制得的乙炔中还可能含有少量还原性的杂质气体,由此他提出必须先除去,再与溴水反应.请你回答下列问题: 某无色溶液中阴离子为Cl-,阳离子可能含有下列离子中的一种或几种:H+、K+、Al3+、NH4+、Fe3+,向该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入NaOH 溶液的体积(V)的关系如图所示.
某无色溶液中阴离子为Cl-,阳离子可能含有下列离子中的一种或几种:H+、K+、Al3+、NH4+、Fe3+,向该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入NaOH 溶液的体积(V)的关系如图所示.