题目内容
水的电离平衡曲线如图所示,下列说法正确的是( )
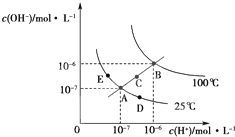

| A、图中五点KW间的关系:B=C=A=D=E |
| B、若处在B点时,将pH=2的硫酸与pH=10的KOH溶液等体积混合,溶液显酸性 |
| C、若从A点到C点,可采用:温度不变在水中加入适量的NH4Cl固体 |
| D、若从A点到D点,可采用:温度不变在水中加入少量的酸 |
考点:离子积常数,水的电离
专题:
分析:A、水的电离是吸热的,温度越高,离子积越大;
B、根据溶液混合后pH的计算方法来判断;
C、温度不变在水中加入适量的NH4Cl固体,会促进水的电离,溶液显示酸性,据图示信息来判断;
D、温度不变在水中加入少量的酸,会抑制水的电离,溶液显示酸性,据图示信息来判断.
B、根据溶液混合后pH的计算方法来判断;
C、温度不变在水中加入适量的NH4Cl固体,会促进水的电离,溶液显示酸性,据图示信息来判断;
D、温度不变在水中加入少量的酸,会抑制水的电离,溶液显示酸性,据图示信息来判断.
解答:
解:A、水的电离是吸热反应,升高温度促进水电离,所以温度越高,水的离子积常数越大,依据图象分析可知,水的离子积常数关系为:B>C>A=D=E,故A错误;
B、处在B点时,Kw=10-12,将pH=2的硫酸与pH=10的KOH溶液等体积混合,溶液显中性,故B错误;
C、温度不变,Kw不变,向水中加入氯化铵固体,溶液中c(OH-)变大,c(H+)变大,溶液显示酸性,氢离子浓度大于氢氧根浓度,故C错误;
D、温度不变在水中加入少量的酸,会抑制水的电离,溶液中c(OH-)变小,c(H+)变大,溶液显示酸性,故D正确.
故选D.
B、处在B点时,Kw=10-12,将pH=2的硫酸与pH=10的KOH溶液等体积混合,溶液显中性,故B错误;
C、温度不变,Kw不变,向水中加入氯化铵固体,溶液中c(OH-)变大,c(H+)变大,溶液显示酸性,氢离子浓度大于氢氧根浓度,故C错误;
D、温度不变在水中加入少量的酸,会抑制水的电离,溶液中c(OH-)变小,c(H+)变大,溶液显示酸性,故D正确.
故选D.
点评:本题考查水的电离平衡移动问题,结合图象判断并分析溶液在不同温度下的Kw,做题时注意根据图象比较c(H+)和c(OH-)的大小.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目
化学是一门中心学科,与社会、生活、科研密切的关系.下列叙述中正确的是( )
| A、将表面有铜绿[Cu2(OH)2CO3]的铜器放入硝酸中浸泡,除去铜绿 |
| B、大量使用煤发电是形成雾霾的主要原因,天然气、煤气大量泄露遇到明火会爆炸 |
| C、利用化学反应可实现12C到14C的转化,高炉炼铁是炼铁最常用的方法 |
| D、青铜(铜锡合金)是一种复合材料,二氧化硅可以做光导纤维 |
下列实验现象描述正确的是( )
| A、新制氯水滴入石蕊试液中,只能看到试液变红 |
| B、铜丝在Cl2中燃烧后向集气瓶中加水,溶液呈蓝绿色,说明CuCl2是蓝绿色的 |
| C、饱和氯水光照时有气泡产生,该气体为氯气 |
| D、钠在氯气中燃烧,火焰呈黄色,集气瓶中生成白烟 |
恒温下将1molN2和3mol H2 在体积为2L的容器中混合,发生如下反应:N2(g)+3H2(g)?2NH3(g),2s后测得NH3的体积分数为25%,则下列说法中不正确的是( )
| A、用N2浓度的减少表示的平均反应速率为0.2mol?L-1?s-1 |
| B、2s时N2的转化率为40% |
| C、2s时混合气体中n(N2):n(H2):n(NH3)═3:9:4 |
| D、2s时NH3的浓度为0.4mol/L |
 如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)( )
如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)( )| A、杠杆为导体和绝缘体时,均为A端高B端低 |
| B、杠杆为导体和绝缘体时,均为A端低B端高 |
| C、当杠杆为绝缘体时,A端低,B端高;为导体时,A端高,B端低 |
| D、当杠杆为绝缘体时,A端高,B端低;为导体时,A端低,B端高 |



 如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题
如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题