题目内容
在做盐跟盐反应的分组实验时,第一组学生进行BaCl2与Na2CO3溶液的反应,第二组学生进行BaCl2与Na2SO4溶液的反应.实验结束后,两组同学将全部的浊液集中倒进一个废液缸中.浊液中白色沉淀物质是 和 .
化学兴趣小组对浊液进行过滤,探究滤液的成分.
【提出问题】滤液里除了NaCl外,还有什么物质?
【提出猜想】猜想①: ;猜想②:Na2SO4;猜想③:Na2CO3;猜想④:Na2CO3、Na2SO4
【实验探究】

(1)若现象a只有白色沉淀,则猜想 成立,请写出该反应的化学方程式 ;
(2)若现象a只有气泡产生,则猜想 可能成立,请写出该反应的化学方程式 ;
(3)若现象b产生白色沉淀,然后加稀硝酸沉淀部分溶解,并产生气泡,则猜想 成立;
(4)若沉淀全部不溶解,则猜想 成立.
化学兴趣小组对浊液进行过滤,探究滤液的成分.
【提出问题】滤液里除了NaCl外,还有什么物质?
【提出猜想】猜想①:
【实验探究】

(1)若现象a只有白色沉淀,则猜想
(2)若现象a只有气泡产生,则猜想
(3)若现象b产生白色沉淀,然后加稀硝酸沉淀部分溶解,并产生气泡,则猜想
(4)若沉淀全部不溶解,则猜想
考点:几组未知物的检验
专题:物质检验鉴别题
分析:BaCl2与Na2CO3溶液的反应生成氯化钠和碳酸钡白色沉淀,BaCl2与Na2SO4溶液的反应生成氯化钠和硫酸钡白色沉淀,根据反应物质的过量情况,可以是氯化钡过量,还可以是碳酸钠或是硫酸钠过量等,据此确定猜想的情况;
(1)只有氯化钡可以和硫酸反应生成白色沉淀硫酸钡;
(2)只有碳酸钠可以和硫酸反应生成二氧化碳气体;
(3)白色沉淀碳酸钡加稀硝酸沉淀溶解,白色沉淀硫酸钡中加入硝酸,沉淀不溶解,碳酸钠可以和酸反应生成二氧化碳气体,产生气泡;
(4)白色沉淀硫酸钡中加入硝酸,沉淀不溶解.
(1)只有氯化钡可以和硫酸反应生成白色沉淀硫酸钡;
(2)只有碳酸钠可以和硫酸反应生成二氧化碳气体;
(3)白色沉淀碳酸钡加稀硝酸沉淀溶解,白色沉淀硫酸钡中加入硝酸,沉淀不溶解,碳酸钠可以和酸反应生成二氧化碳气体,产生气泡;
(4)白色沉淀硫酸钡中加入硝酸,沉淀不溶解.
解答:
解:BaCl2与Na2CO3溶液的反应生成氯化钠和碳酸钡白色沉淀,BaCl2与Na2SO4溶液的反应生成氯化钠和硫酸钡白色沉淀,所以浊液中白色沉淀物质是BaCO3和BaSO4,故答案为:BaCO3;BaSO4;
【提出猜想】根据BaCl2与Na2CO3溶液的反应、BaCl2与Na2SO4溶液的反应,结合反应物质的过量情况,可以是氯化钡过量,还可以是碳酸钠或是硫酸钠过量,或是碳酸钠和硫酸钠都过量,故答案为:BaCl2;
【实验探究】
(1)只有氯化钡可以和硫酸反应生成白色沉淀硫酸钡,若现象a只有白色沉淀,则滤液里除了NaCl外,还有氯化钡,BaCl2+H2SO4=2NaCl+BaSO4↓,故答案为:①;BaCl2+H2SO4=2NaCl+BaSO4↓;
(2)只有碳酸钠可以和硫酸反应生成二氧化碳气体,若现象a只有气泡产生,则滤液里除了NaCl外,还有氯碳酸钠,2HCl+Na2CO3=2NaCl+H2O+CO2↑,故答案为:③;2HCl+Na2CO3=2NaCl+H2O+CO2↑;
(3)白色沉淀碳酸钡加稀硝酸沉淀溶解,白色沉淀硫酸钡中加入硝酸,沉淀不溶解,碳酸钠可以和酸反应生成二氧化碳气体,产生气泡,若现象b产生白色沉淀,然后加稀硝酸沉淀部分溶解,并产生气泡,则滤液里除了NaCl外,还有氯碳酸钠和硫酸钠,则猜想④成立,故答案为:④;
(4)白色沉淀硫酸钡中加入硝酸,沉淀不溶解,若沉淀全部不溶解,则滤液里除了NaCl外,还有硫酸钠,故答案为:②.
【提出猜想】根据BaCl2与Na2CO3溶液的反应、BaCl2与Na2SO4溶液的反应,结合反应物质的过量情况,可以是氯化钡过量,还可以是碳酸钠或是硫酸钠过量,或是碳酸钠和硫酸钠都过量,故答案为:BaCl2;
【实验探究】
(1)只有氯化钡可以和硫酸反应生成白色沉淀硫酸钡,若现象a只有白色沉淀,则滤液里除了NaCl外,还有氯化钡,BaCl2+H2SO4=2NaCl+BaSO4↓,故答案为:①;BaCl2+H2SO4=2NaCl+BaSO4↓;
(2)只有碳酸钠可以和硫酸反应生成二氧化碳气体,若现象a只有气泡产生,则滤液里除了NaCl外,还有氯碳酸钠,2HCl+Na2CO3=2NaCl+H2O+CO2↑,故答案为:③;2HCl+Na2CO3=2NaCl+H2O+CO2↑;
(3)白色沉淀碳酸钡加稀硝酸沉淀溶解,白色沉淀硫酸钡中加入硝酸,沉淀不溶解,碳酸钠可以和酸反应生成二氧化碳气体,产生气泡,若现象b产生白色沉淀,然后加稀硝酸沉淀部分溶解,并产生气泡,则滤液里除了NaCl外,还有氯碳酸钠和硫酸钠,则猜想④成立,故答案为:④;
(4)白色沉淀硫酸钡中加入硝酸,沉淀不溶解,若沉淀全部不溶解,则滤液里除了NaCl外,还有硫酸钠,故答案为:②.
点评:本题考查学生物质的检验知识,注意离子的特征离子反应以及物质的性质是解题的关键,难度不大.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
环境、能源和资源是人类面临的三大问题.下列关于能源和环境的说法中,不正确的是( )
| A、凡是能提供能量的资源都是能源 |
| B、解决能源危机的有效办法包括提高能源利用率、寻找新能源等 |
| C、化石燃料不可再生、易产生污染,且储量有限,是一种有局限性的能源 |
| D、雾霾中含有大量的PM2.5可吸入颗粒,汽车尾气与雾霾的形成无关 |
在容积不变的密闭容器中存在如下反应2SO2(g)+O2(g)?2SO3(g)△H<0,某研究小组探究其他条件下不变时,改变某一条件对上述反应的影响,下列分析正确的是( )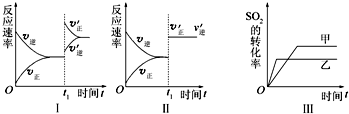

| A、图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响 |
| B、图Ⅱ表示的是t1时刻加入催化剂后对反应速率的影响 |
| C、图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙的高 |
| D、图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高 |
水的电离平衡曲线如图所示,下列说法正确的是( )
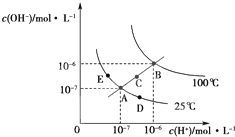

| A、图中五点KW间的关系:B=C=A=D=E |
| B、若处在B点时,将pH=2的硫酸与pH=10的KOH溶液等体积混合,溶液显酸性 |
| C、若从A点到C点,可采用:温度不变在水中加入适量的NH4Cl固体 |
| D、若从A点到D点,可采用:温度不变在水中加入少量的酸 |
 可逆反应2X+Y?2Z在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量n(z)与反应时间(t)的关系如图所示.下列判断正确的是 ( )
可逆反应2X+Y?2Z在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量n(z)与反应时间(t)的关系如图所示.下列判断正确的是 ( )| A、T1<T2,P1<P2 |
| B、T1<T2,P1>P2 |
| C、T1>T2,P1>P2 |
| D、T1>T2,P1<P2 |
下列各组离子,在强碱性溶液中可以大量共存的是( )
| A、Na+、Br-、Cl-、S2- |
| B、Na+、K+、NH4+、Ba2+ |
| C、Ca2+、K+、Cl-、CO32- |
| D、SO32-、NO3-、SO42-、HCO3- |
已知:①1mol H2分子中化学键断裂时需要吸收436kJ的能量,②1mol I2蒸气中化学键断裂时需要吸收151kJ的能量,③由H原子和I原子形成1mol HI分子时释放299kJ的能量.下列热化学方程式正确的是( )
| A、2HI(g)═H2(g)+I2(g)△H=+11kJ/mol | ||||
B、
| ||||
| C、H2(g)+I2(g)═2HI(g)△H=+288kJ/mol | ||||
D、
|