题目内容
实验室通常用粗锌和稀硫酸反应制氢气,在其废液中含有大量的硫酸锌,由于粗锌中还含有铁,使溶液中含有一定量的硫酸亚铁.某兴趣小组的同学用上述废液为原料制取皓矾(ZnSO4.7H2O)并探究其性质.
(1)制备皓矾的实验流程如图.

已知:开始生成氢氧化物沉淀到沉淀完全的pH范围分别为:Fe(OH)3:2.7→3.7,
Fe(OH)2:7.6→9.6,Zn(OH)2:5.7→8.0,试回答:
①从溶液A到溶液B所加入试剂①的目的是 ,应选择试剂
A.氨水 B.NaCLO溶液 C.20%的 H2O2 D.浓硫酸
②加入试剂 ②的目的是调节溶液的PH值,使铁元素完全沉淀,以得到较纯的ZnSO4溶液,加入的试剂②最好是 .
③从晶体1→晶体2,该过程的名称是 .
④在得到皓矾时,向晶体中加入少量酒精洗涤而不用水的原因是 .
(2)探究ZnSO4.7H2O的性质称取28.7gZnSO4.7H2O研细后置于坩埚中小心加热,测得残留固体的质量与温度的对应数据见下表:
①ZnSO4.7H2O加热到1000℃时分解产生的气体产物除水蒸汽、SO3、SO2外还可能有 (写化学式),写出一种可能的化学反应方程式 .
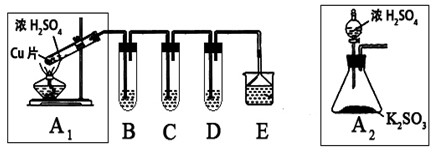
②为进一步探究确认分解生成的气体组成,某同学设计了一个测定各组分含量的实验方案,其可能用到的仪器如图所示:

按装置从左至右的方向,各仪器接口连接顺序为①→⑨→⑩→ → → → → → →②(填序号).
(1)制备皓矾的实验流程如图.

已知:开始生成氢氧化物沉淀到沉淀完全的pH范围分别为:Fe(OH)3:2.7→3.7,
Fe(OH)2:7.6→9.6,Zn(OH)2:5.7→8.0,试回答:
①从溶液A到溶液B所加入试剂①的目的是
A.氨水 B.NaCLO溶液 C.20%的 H2O2 D.浓硫酸
②加入试剂 ②的目的是调节溶液的PH值,使铁元素完全沉淀,以得到较纯的ZnSO4溶液,加入的试剂②最好是
③从晶体1→晶体2,该过程的名称是
④在得到皓矾时,向晶体中加入少量酒精洗涤而不用水的原因是
(2)探究ZnSO4.7H2O的性质称取28.7gZnSO4.7H2O研细后置于坩埚中小心加热,测得残留固体的质量与温度的对应数据见下表:
| 温度(℃) | 60 | 240 | 930 | 1000 |
| 残留固体质量(g) | 19.7 | 16.1 | 8.1 | 8.1 |
②为进一步探究确认分解生成的气体组成,某同学设计了一个测定各组分含量的实验方案,其可能用到的仪器如图所示:

按装置从左至右的方向,各仪器接口连接顺序为①→⑨→⑩→
考点:性质实验方案的设计,探究物质的组成或测量物质的含量
专题:实验设计题
分析:(1)①依据流程分析判断,试剂1是为了把亚铁离子氧化为铁离子,在PH=2.7-3.可以全部沉淀,其他离子不沉淀,同时加入的试剂不能引入新的杂质;
②试剂2是用来调节溶液PH到3.7,目的让铁离子全部沉淀,除杂实验不能引入新的杂质;
③晶体重新结晶的过程是物质提纯的方法是重结晶;
④洗涤晶体表面的杂质离子,同时减少皓钒晶体的损失;
(2)①根据ZnSO4?7H2O加热到1000℃时所的固体的质量情况来确定成分;
②依据分解生成的气体为三氧化硫、二氧化硫、氧气分析.
②试剂2是用来调节溶液PH到3.7,目的让铁离子全部沉淀,除杂实验不能引入新的杂质;
③晶体重新结晶的过程是物质提纯的方法是重结晶;
④洗涤晶体表面的杂质离子,同时减少皓钒晶体的损失;
(2)①根据ZnSO4?7H2O加热到1000℃时所的固体的质量情况来确定成分;
②依据分解生成的气体为三氧化硫、二氧化硫、氧气分析.
解答:
解:(1)①化学实验室通常用粗锌和稀硫酸反应制氢气,因此在制氢废液中含有大量的硫酸锌.同时,由于粗锌中还含有铁等杂质,溶于酸后生成亚铁离子锌离子,依据开始生成氢氧化物沉淀到沉淀完全的pH范围分别为:Fe(OH)3:2.7-3.7Fe(OH)2:7.6-9.6 Zn(OH)2:5.7-8,分析判断,直接沉淀亚铁离子,锌离子也会全部全部沉淀,不能实现实验目的和要求,除去亚铁离子需要先把亚铁离子氧化为铁离子,调节溶液PH使三价铁离子全部沉淀,此时锌离子不沉淀,来实现分离,加入的氧化剂不能引入新的杂质,氨水、NaClO溶液、20%的H2O2、浓硫酸、浓硝酸中只有20%的H2O2 在氧化亚铁离子不引入杂质;
故答案为:将制氢废液中的Fe2+氧化成Fe3+,同时避免引入新的杂质;C;
②试剂2是用来调节溶液PH到3.7,目的让铁离子全部沉淀,除杂实验不能引入新的杂质;Zn粉会把氧化得到的铁离子还原,起不到除去的作用,ZnO、Zn(OH)2、ZnCO3可以反应调节溶液PH到3.7,使铁离子沉淀,同时不引入新的杂质,ZnSO4不能调节溶液PH,且引入杂质硫酸根离子;
故答案为:ZnO、Zn(OH)2、ZnCO3;
③晶体溶解再结晶是提纯晶体的方法为重结晶;故答案为:重结晶;
④洗涤晶体表面的杂质离子,同时减少皓钒晶体的损失;在得到皓矾时,向晶体中加入少量酒精洗涤而不用水的原因是,晶体溶于水,不溶于酒精,所以目的是为了冲洗掉晶体表面的杂质离子;防止晶体溶解,影响产率;故答案为:为了冲洗掉晶体表面的杂质离子;防止晶体溶解,影响产率;
(2)①ZnSO4?7H2O加热到1000℃时所的固体的质量为8.1g,加热到60°会将所有的结晶水失去,到1000℃时硫酸锌已经分解为氧化锌、三氧化硫,三氧化硫可以写成二氧化硫和氧气;
故答案为:O2,ZnSO4?7H2O
ZnO+SO3+7H2O;
②依据分解生成的气体为三氧化硫、二氧化硫、氧气分析,按装置从左至右的方向,各仪器接口连接顺序为①→⑨→⑩→,先通过饱和亚硫酸钠溶液吸收三氧化硫反应生成二氧化硫,通过浓硫酸干燥气体后通过碱石灰吸收二氧化硫,最后利用排水量气法测定氧气体积,依据氧气和生成二氧化硫之间的电子守恒计算费用生成二氧化硫,最后得到三氧化硫,所以装置连接为:①→⑨→⑩→⑥→⑤→③→④→⑧→⑦→②;
故答案为:⑥⑤③④⑧⑦;
故答案为:将制氢废液中的Fe2+氧化成Fe3+,同时避免引入新的杂质;C;
②试剂2是用来调节溶液PH到3.7,目的让铁离子全部沉淀,除杂实验不能引入新的杂质;Zn粉会把氧化得到的铁离子还原,起不到除去的作用,ZnO、Zn(OH)2、ZnCO3可以反应调节溶液PH到3.7,使铁离子沉淀,同时不引入新的杂质,ZnSO4不能调节溶液PH,且引入杂质硫酸根离子;
故答案为:ZnO、Zn(OH)2、ZnCO3;
③晶体溶解再结晶是提纯晶体的方法为重结晶;故答案为:重结晶;
④洗涤晶体表面的杂质离子,同时减少皓钒晶体的损失;在得到皓矾时,向晶体中加入少量酒精洗涤而不用水的原因是,晶体溶于水,不溶于酒精,所以目的是为了冲洗掉晶体表面的杂质离子;防止晶体溶解,影响产率;故答案为:为了冲洗掉晶体表面的杂质离子;防止晶体溶解,影响产率;
(2)①ZnSO4?7H2O加热到1000℃时所的固体的质量为8.1g,加热到60°会将所有的结晶水失去,到1000℃时硫酸锌已经分解为氧化锌、三氧化硫,三氧化硫可以写成二氧化硫和氧气;
故答案为:O2,ZnSO4?7H2O
| ||
②依据分解生成的气体为三氧化硫、二氧化硫、氧气分析,按装置从左至右的方向,各仪器接口连接顺序为①→⑨→⑩→,先通过饱和亚硫酸钠溶液吸收三氧化硫反应生成二氧化硫,通过浓硫酸干燥气体后通过碱石灰吸收二氧化硫,最后利用排水量气法测定氧气体积,依据氧气和生成二氧化硫之间的电子守恒计算费用生成二氧化硫,最后得到三氧化硫,所以装置连接为:①→⑨→⑩→⑥→⑤→③→④→⑧→⑦→②;
故答案为:⑥⑤③④⑧⑦;
点评:本题是一道关于物质的分离和提纯的综合实验设计题,考查学生分析和解决问题的能力,难度大.

练习册系列答案
相关题目
下列反应不属于可逆反应的是( )
| A、氯气溶于水 | |||
| B、氨气溶于水 | |||
C、可充电电池的反应如2Ag+Zn(OH)2
| |||
| D、工业合成氨 |
环境、能源和资源是人类面临的三大问题.下列关于能源和环境的说法中,不正确的是( )
| A、凡是能提供能量的资源都是能源 |
| B、解决能源危机的有效办法包括提高能源利用率、寻找新能源等 |
| C、化石燃料不可再生、易产生污染,且储量有限,是一种有局限性的能源 |
| D、雾霾中含有大量的PM2.5可吸入颗粒,汽车尾气与雾霾的形成无关 |
在容积不变的密闭容器中存在如下反应2SO2(g)+O2(g)?2SO3(g)△H<0,某研究小组探究其他条件下不变时,改变某一条件对上述反应的影响,下列分析正确的是( )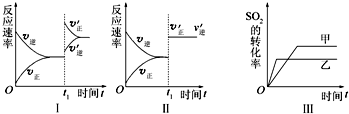

| A、图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响 |
| B、图Ⅱ表示的是t1时刻加入催化剂后对反应速率的影响 |
| C、图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙的高 |
| D、图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高 |
水的电离平衡曲线如图所示,下列说法正确的是( )
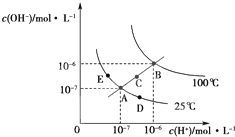

| A、图中五点KW间的关系:B=C=A=D=E |
| B、若处在B点时,将pH=2的硫酸与pH=10的KOH溶液等体积混合,溶液显酸性 |
| C、若从A点到C点,可采用:温度不变在水中加入适量的NH4Cl固体 |
| D、若从A点到D点,可采用:温度不变在水中加入少量的酸 |
下列各组离子,在强碱性溶液中可以大量共存的是( )
| A、Na+、Br-、Cl-、S2- |
| B、Na+、K+、NH4+、Ba2+ |
| C、Ca2+、K+、Cl-、CO32- |
| D、SO32-、NO3-、SO42-、HCO3- |