题目内容
3.工业废气H2S经资源利用后可回收能量并得到单质硫.反应原理如图所示.下列说法不正确的是( )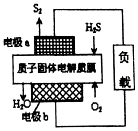
| A. | 电极a为电池的负极 | |
| B. | 电极b上发生的电极反应为O2+4H++4e-═2H2O | |
| C. | 若电路中通过2mol电子,则电池内部释放632kJ热量 | |
| D. | 若有17gH2S参与反应,则会有1molH+经质子膜进入正极区 |
分析 根据反应原理图可知,H2S失电子发生氧化反应生成S2,则a为负极,b为正极,O2得电子发生还原反应,电极反应为O2+4H++4e-═2H2O,据此分析解答.
解答 解:A、H2S失电子发生氧化反应生成S2,则a为负极,故A正确;
B、b为正极,O2得电子发生还原反应,电极反应为O2+4H++4e-═2H2O,故B正确;
C、电路中每流过4mol电子,则消耗1mol氧气,但该装置将化学能转化为电能,所以电池内部几乎不放出能量,故C错误;
D、每17g即$\frac{17}{34}$mol=0.5molH2S参与反应,则消耗0.25mol氧气,则根据O2+4H++4e-=2H2O,所以有1mol H+经质子膜进入正极区,故D正确;
故选C.
点评 本题侧重考查原电池原理,明确电解质溶液酸碱性是解本题关键,难点是电极反应式的书写,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.某铁的氧化物1.52g溶于足量稀硫酸中,向所得溶液中通入标准状况下112mL SO3,恰好将Fe3+完全还原,则该氧化物的化学式为( )
| A. | Fe2O3 | B. | Fe3O4 | C. | Fe4O5 | D. | Fe6O7 |
11.A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍.B 在D中充分燃烧能生成其最高价化合物BD2.E+与D2-具有相同的电子数.A在F中燃烧,产物溶于水得到一种强酸.回答下列问题:
(1)A在周期表中的位置是第一周期ⅠA族,写出一种工业制备单质F的离子方程式2Cl-+2H2O $\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑.
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为纯碱(或苏打),其水溶液与F单质反应后,在产物中加入少量KI,反应后加人CC14并振荡,有 机层显紫色.
(3)由这些元素组成的物质,其组成和结构信息如表:
a的化学式为NaH;b的化学式为Na2O2和Na2C2; c的电子式为 .
.
(1)A在周期表中的位置是第一周期ⅠA族,写出一种工业制备单质F的离子方程式2Cl-+2H2O $\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑.
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为纯碱(或苏打),其水溶液与F单质反应后,在产物中加入少量KI,反应后加人CC14并振荡,有 机层显紫色.
(3)由这些元素组成的物质,其组成和结构信息如表:
| 物质 | 组成和结构信息 |
| a | 含有A的二元离子化合物 |
| b | 含有非极性共价键的二元离子化合物,且原子数之比为1:1 |
| c | 化学组成为BDF2 |
| d | 只存在一种类型作用力且可导电的单质晶体 |
 .
.
18.化学与人类生活、生产和社会可持续发展密切相关.下列说法不正确的是( )
| A. | 利用乙醇的还原性以及Cr3+、Cr2O72-的颜色差异来检验是否酒后驾车 | |
| B. | PM2.5是指大气中直径小于或等于2.5微米的颗粒物,是产生雾霾天气的主要因素 | |
| C. | 成分为盐酸的洁厕灵与84消毒液混合使用易中毒:Cl-+ClO-+2H+═Cl2↑+H2O | |
| D. | 天然纤维与合成纤维的主要成分都部是纤维素 |
8.下列物质不属于合金的是( )
| A. | 钢铁 | B. | 水银 | C. | 硬铝 | D. | 青铜 |
15.下列说法正确的是( )
| A. | 芳香烃都符合通式CnH2n-6(n≥6) | B. | 分子中含苯环的化合物都是芳香烃 | ||
| C. | 芳香烃都有香味,因此得名 | D. | 芳香烃属于芳香族化合物 |
12.下列电子式正确的是( )
| A. |  | B. |  | C. |  | D. |  |
13.A、B、C、D、E是五种短周期元素,A的某种原子失去一个电子后可形成一个质子,B的某种单质是自然界中最硬的物质,C的某种单质是生物呼吸必需的气体,D元素原子的K层和M层电子数相同,E是短周期金属性最强的元素.下列说法正确的是( )
| A. | C、D、E的简单离子半径由大到小的顺序是E>D>C | |
| B. | 含有E的盐溶液可能显酸性、可能显中性、也可能显碱性 | |
| C. | A和C形成的化合物中一定只有极性键 | |
| D. | BC2跟C、E形成的化合物发生的反应都是非氧化还原反应 |