题目内容
12.下列电子式正确的是( )| A. |  | B. |  | C. |  | D. |  |
分析 A.氯化镁为离子化合物,必须标出阴阳离子的电子式;
B.过氧化钠是离子化合物,其电子式由阴、阳离子的电子式组合而成,相同的离子不能合并;
C.溴化铵为离子晶体,由铵根离子与溴离子通过离子键结合在一起;
D.双氧水中两个氢原子分别与两个氧原子通过共用一对电子结合,两个氧原子之间通过共用1对电子结合.
解答 解:A.氯化镁为离子化合物,化学式中存在阴阳离子,其电子式中需要标出阴阳离子所带电荷,氯化镁的电子式为 ,故A错误;
,故A错误;
B.Na2O2是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,氧原子得到电子形成过氧根阴离子,电子式为 ,故B正确;
,故B正确;
C.溴化铵是离子化合物,由铵根离子与溴离子构成,电子式为: ,故C错误;
,故C错误;
D.双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为 ,故D错误,
,故D错误,
故选B.
点评 本题考查了电子式的书写,题目难度不大,注意掌握电子式的概念及书写原则,明确离子化合物与共价化合物的电子式表示方法及区别.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
2.下列实验能获得成功的是( )
| A. | 无水乙酸和乙醇共热制取乙酸乙酯 | |
| B. | 将苯逐滴滴入浓硝酸中,并用沸水浴加热制取硝基苯 | |
| C. | 将铜丝在酒精灯上加热后,立即伸人无水乙醇中,铜丝恢复原来的红色 | |
| D. | 淀粉用酸催化水解后的溶液加入新制银氨溶液,水浴加热,可看到有银镜出现 |
3.工业废气H2S经资源利用后可回收能量并得到单质硫.反应原理如图所示.下列说法不正确的是( )

| A. | 电极a为电池的负极 | |
| B. | 电极b上发生的电极反应为O2+4H++4e-═2H2O | |
| C. | 若电路中通过2mol电子,则电池内部释放632kJ热量 | |
| D. | 若有17gH2S参与反应,则会有1molH+经质子膜进入正极区 |
20.现有三组混合液:①乙酸乙酯和乙酸钠溶液 ②乙醇和丁醇 ⑧溴化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
| A. | 分液、萃取、蒸馏 | B. | 萃取、蒸馏、分液 | C. | 分液、蒸馏、萃取 | D. | 蒸馏、萃取、分液 |
7.BaCl2常用作分析试剂,也常直接用于制造钡盐以及电子、仪表、冶金等工业.我国目前比较成熟的生产BaCl2•xH2O的工艺是以重晶石(主要成分BaSO4,杂质为Fe2O3)、无烟煤粉和盐酸为原料生产,流程如图所示(部分产物已略去).

(1)写出BaCl2的电子式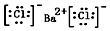 .
.
(2)“还原焙烧”时,使过量的无烟煤粉和重晶石粉混合物在高温下发生反应,该反应的化学方程式为BaSO4+4C$\frac{\underline{\;焙烧\;}}{\;}$BaS+4CO↑.
(3)“盐酸浸”得到的是氯化钡粗液,其中残余的含硫化合物会影响产品质量,必须通过鼓入热空气吹除.鼓入热空气能有效去杂的原理是升高温度可降低H2S的溶解度,利于吹出;升高温度,利于使H2S氧化成S沉淀除去.
(4)生产过程中所产生的尾气含有毒性较高的H2S,为防止环境污染,必须进行吸收处理,下列不可行的吸收液是BC.
A.CuSO4溶液B.浓硫酸C.NaHS溶液D.氨水
(5)随着工艺条件的不同,产品BaCl2•xH2O中的x数值有所不同.产品检验部门通常采用的操作是:Ⅰ称取样品a g;Ⅱ充分加热;Ⅲ置于干燥器中冷却;Ⅳ称量质量为b g.由此可得出x=$\frac{208(a-b)}{18b}$(请写出计算表达式).
(6)工业检测MgCl2•xH2O中的x值时不用以上加热法,而多采用沉淀滴定法,其原因是(用化学方程式表示)MgCl2•xH2O$\frac{\underline{\;\;△\;\;}}{\;}$MgO+2HCl+(x-1)H2O.沉淀滴定的测定步骤为:称取0.5000g待测产品,用适量硝酸溶解,滴加指示剂,用AgNO3标准溶液滴定.
根据上表数据分析,该滴定可选用Na2CrO4作指示剂.使用该指示剂时,判断滴定达到终点的现象是当滴入最后一滴AgNO3溶液出现砖红色沉淀,放置30s砖红色不消失.

(1)写出BaCl2的电子式
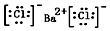 .
.(2)“还原焙烧”时,使过量的无烟煤粉和重晶石粉混合物在高温下发生反应,该反应的化学方程式为BaSO4+4C$\frac{\underline{\;焙烧\;}}{\;}$BaS+4CO↑.
(3)“盐酸浸”得到的是氯化钡粗液,其中残余的含硫化合物会影响产品质量,必须通过鼓入热空气吹除.鼓入热空气能有效去杂的原理是升高温度可降低H2S的溶解度,利于吹出;升高温度,利于使H2S氧化成S沉淀除去.
(4)生产过程中所产生的尾气含有毒性较高的H2S,为防止环境污染,必须进行吸收处理,下列不可行的吸收液是BC.
A.CuSO4溶液B.浓硫酸C.NaHS溶液D.氨水
(5)随着工艺条件的不同,产品BaCl2•xH2O中的x数值有所不同.产品检验部门通常采用的操作是:Ⅰ称取样品a g;Ⅱ充分加热;Ⅲ置于干燥器中冷却;Ⅳ称量质量为b g.由此可得出x=$\frac{208(a-b)}{18b}$(请写出计算表达式).
(6)工业检测MgCl2•xH2O中的x值时不用以上加热法,而多采用沉淀滴定法,其原因是(用化学方程式表示)MgCl2•xH2O$\frac{\underline{\;\;△\;\;}}{\;}$MgO+2HCl+(x-1)H2O.沉淀滴定的测定步骤为:称取0.5000g待测产品,用适量硝酸溶解,滴加指示剂,用AgNO3标准溶液滴定.
| AgCl | AgI | Ag2CrO4 | |
| Ksp | 2×10-10 | 8.3×10-17 | 2×10-12 |
| 颜色 | 白 | 黄 | 砖红 |
17. 伏打电堆是由几组锌和银的圆板堆积而成,所有的圆板之间夹放着几张盐水泡过的布.图为最初的伏打电堆模型,由八组锌和银串联组成的圆板堆积而成.下列说法正确的是( )
伏打电堆是由几组锌和银的圆板堆积而成,所有的圆板之间夹放着几张盐水泡过的布.图为最初的伏打电堆模型,由八组锌和银串联组成的圆板堆积而成.下列说法正确的是( )
 伏打电堆是由几组锌和银的圆板堆积而成,所有的圆板之间夹放着几张盐水泡过的布.图为最初的伏打电堆模型,由八组锌和银串联组成的圆板堆积而成.下列说法正确的是( )
伏打电堆是由几组锌和银的圆板堆积而成,所有的圆板之间夹放着几张盐水泡过的布.图为最初的伏打电堆模型,由八组锌和银串联组成的圆板堆积而成.下列说法正确的是( )| A. | 该原电池正极的电极方程式为:O2+4e-+4H+═2H2O | |
| B. | 电池长时间工作后,中间的布上会有白色固体颗粒生成,该固体颗粒为Ag2O | |
| C. | 当电路中转移0.2 mol电子时,消耗锌板的总质量为52 g | |
| D. | 该伏打电堆工作时,在银板附近会有Cl2放出 |
4.工业上用含锰废料(主要成分MnO2,含有少量Fe2O3、Al2O3、CuO、CaO等)与烟气脱硫进行联合处理并制备MnSO4的流程如图1:

已知:25℃时,部分氢氧化物的溶度积常数(Ksp)如表所示.
请回答:
(1)沉淀1的化学式为CaSO4.
(2)(NH4)2S的电子式为 ;“净化”时,加入(NH4)2S的作用为使Cu2+转化为CuS沉淀.
;“净化”时,加入(NH4)2S的作用为使Cu2+转化为CuS沉淀.
(3)“酸化、还原”中,发生的所有氧化还原反应的离子方程式为.
(4)已知:滤液3中除MnSO4外,还含有少量(NH4)2SO4.(NH4)2SO4、MnSO4的溶解度曲线如图2所示.
据此判断,操作“I”应为蒸发浓缩、趁热过滤、洗涤、干燥.
(5)工业上可用电解酸性MnSO4溶液的方法制备MnO2,其阳极反应式为Mn2++2H2O-2e-=MnO2+4H+.
(6)25.35g MnSO4•H2O样品受热分解过程的热重曲线(样品质量随温度变化的曲线)如图3所示.
①300℃时,所得固体的化学式为MnSO4.
②1150℃时,反应的化学方程式为3MnO2$\frac{\underline{\;1150℃\;}}{\;}$Mn3O4+O2↑.

已知:25℃时,部分氢氧化物的溶度积常数(Ksp)如表所示.
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Cu(OH)2 | Mn(OH)2 |
| Ksp | 1.0×10-33 | 4.0×10-38 | 2.0×10-20 | 4.0×10-14 |
(1)沉淀1的化学式为CaSO4.
(2)(NH4)2S的电子式为
 ;“净化”时,加入(NH4)2S的作用为使Cu2+转化为CuS沉淀.
;“净化”时,加入(NH4)2S的作用为使Cu2+转化为CuS沉淀.(3)“酸化、还原”中,发生的所有氧化还原反应的离子方程式为.
(4)已知:滤液3中除MnSO4外,还含有少量(NH4)2SO4.(NH4)2SO4、MnSO4的溶解度曲线如图2所示.
据此判断,操作“I”应为蒸发浓缩、趁热过滤、洗涤、干燥.
(5)工业上可用电解酸性MnSO4溶液的方法制备MnO2,其阳极反应式为Mn2++2H2O-2e-=MnO2+4H+.
(6)25.35g MnSO4•H2O样品受热分解过程的热重曲线(样品质量随温度变化的曲线)如图3所示.
①300℃时,所得固体的化学式为MnSO4.
②1150℃时,反应的化学方程式为3MnO2$\frac{\underline{\;1150℃\;}}{\;}$Mn3O4+O2↑.
1.用一种阴、阳离子双隔膜三室电解槽处理废水中的NH4+,模拟装置如图所示.下列说法不正确的是( )

| A. | 阳极室溶液由无色变成浅绿色 | |
| B. | 当电路中通过lmol电子的电量时,阴极有0.5mol的气体生成 | |
| C. | 电解时中间室(NH4)2SO4溶液浓度下降 | |
| D. | 电解一段时间后,阴极室溶液中的溶质一定是(NH4)3PO4 |
2.两种气态烃的混合物共2.24L(标准状况下),完全燃烧后得3.36L(标准状况下)二氧化碳和3.6g的水.下列说法中,正确的是( )
| A. | 混合气体中一定含有甲烷 | B. | 混合气体中一定含有乙烯 | ||
| C. | 混合气体中一定含有甲烷和乙烯 | D. | 混合气体中一定含有乙烷 |