题目内容
11.A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍.B 在D中充分燃烧能生成其最高价化合物BD2.E+与D2-具有相同的电子数.A在F中燃烧,产物溶于水得到一种强酸.回答下列问题:(1)A在周期表中的位置是第一周期ⅠA族,写出一种工业制备单质F的离子方程式2Cl-+2H2O $\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑.
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为纯碱(或苏打),其水溶液与F单质反应后,在产物中加入少量KI,反应后加人CC14并振荡,有 机层显紫色.
(3)由这些元素组成的物质,其组成和结构信息如表:
| 物质 | 组成和结构信息 |
| a | 含有A的二元离子化合物 |
| b | 含有非极性共价键的二元离子化合物,且原子数之比为1:1 |
| c | 化学组成为BDF2 |
| d | 只存在一种类型作用力且可导电的单质晶体 |
 .
.
分析 A,B,D,E,F为短周期元素,非金属元素A最外层电子数与其周期数相同,则A为H;B的最外层电子数是其所在周期数的2倍,则B为C或S,B在D中充分燃烧能生成其最高价化合物BD2,则D为O,B的最高正价为+4价,则B为C;E+与D2-具有相同的电子数,则E为Na;A在F中燃烧,产物溶于水得到种强酸,则F为Cl;
(1)根据H在周期表中的位置分析;工业上常用电解饱和食盐水的方法来制备氯气;
(2)C、O、Na组成的化合物为碳酸钠;碳酸钠与氯气反应生成氯化钠、次氯酸钠、碳酸氢钠,次氯酸钠能与KI反应生成碘单质;
(3)这几种元素只有Na能与H形成离子化合物;根据常见的氧的化合物和碳的化合物分析;根据COCl2结构式分析;只存在一种类型作用力且可导电的单质晶体为Na,据此进行解答.
解答 解:A,B,D,E,F为短周期元素,非金属元素A最外层电子数与其周期数相同,则A为H;B的最外层电子数是其所在周期数的2倍,则B为C或S,B在D中充分燃烧能生成其最高价化合物BD2,则D为O,B的最高正价为+4价,则B为C;E+与D2-具有相同的电子数,则E为Na;A在F中燃烧,产物溶于水得到种强酸,则F为Cl;
(1)已知A为H在周期表中位于第一周期ⅠA族;工业上常用电解饱和食盐水的方法来制备氯气,其电解离子方程式为:2Cl-+2H2O $\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑;
故答案为:第一周期ⅠA族;2Cl-+2H2O $\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑;
(2)C、O、Na组成的一种盐中,Na的质量分数为43%,则为碳酸钠,其俗名为纯碱(或苏打);碳酸钠与氯气反应生成氯化钠、次氯酸钠、碳酸氢钠,次氯酸钠能与KI反应生成碘单质,反应后加入CCl4并震荡,有机层显紫色;
故答案为:纯碱(或苏打);紫;
(3)这几种元素只有Na能与H形成离子化合物,则a的化学式为NaH;含有非极性共价键的二元离子化合物,且原子数之比为1:1,则为Na2O2和Na2C2;已知COCl2结构式为: ,则其电子式为
,则其电子式为 ;只存在一种类型作用力且可导电的单质晶体为Na,Na属于金属晶体,
;只存在一种类型作用力且可导电的单质晶体为Na,Na属于金属晶体,
故答案为:NaH;Na2O2和Na2C2; .
.
点评 本题考查了物质结构和元素周期表、化学式的推断、电子式的书写、化学方程式和离子方程式的书写等,题目涉及的知识点较多,侧重于考查学生对所学知识点综合应用能力,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 无水乙酸和乙醇共热制取乙酸乙酯 | |
| B. | 将苯逐滴滴入浓硝酸中,并用沸水浴加热制取硝基苯 | |
| C. | 将铜丝在酒精灯上加热后,立即伸人无水乙醇中,铜丝恢复原来的红色 | |
| D. | 淀粉用酸催化水解后的溶液加入新制银氨溶液,水浴加热,可看到有银镜出现 |
| A. | 人们可以利用先进的化学技术和设备制造新的原子 | |
| B. | 人们可以利用催化剂使水变成汽油 | |
| C. | 人们可以利用先进的技术和设备制造新的分子 | |
| D. | 化学科学只能通过实验来探讨物质的性质 |
①SiO2 ②H2SiO3 ③Fe(OH)3 ④CuS ⑤FeCl2 ⑥CaSiO3.
| A. | ②④ | B. | ②④⑤ | C. | ②③④⑤ | D. | ②④⑥ |
| A. | MgCl2晶体 | B. | NaCl溶液 | C. | 液态氯化氢 | D. | 熔融的KOH |
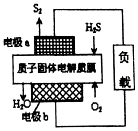
| A. | 电极a为电池的负极 | |
| B. | 电极b上发生的电极反应为O2+4H++4e-═2H2O | |
| C. | 若电路中通过2mol电子,则电池内部释放632kJ热量 | |
| D. | 若有17gH2S参与反应,则会有1molH+经质子膜进入正极区 |
| A. | 分液、萃取、蒸馏 | B. | 萃取、蒸馏、分液 | C. | 分液、蒸馏、萃取 | D. | 蒸馏、萃取、分液 |
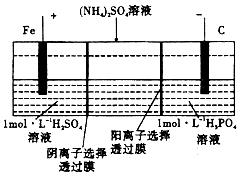
| A. | 阳极室溶液由无色变成浅绿色 | |
| B. | 当电路中通过lmol电子的电量时,阴极有0.5mol的气体生成 | |
| C. | 电解时中间室(NH4)2SO4溶液浓度下降 | |
| D. | 电解一段时间后,阴极室溶液中的溶质一定是(NH4)3PO4 |
