题目内容
4.根据表中信息判断,下列选项不正确的是( )| 序号 | 反应物 | 产物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4 |
| ② | Cl2、FeBr2 | FeCl3、FeBr3 |
| ③ | MnO4- | Cl2、Mn2+ |
| A. | 第①组反应的其余产物为H2O和 O2 | |
| B. | 第②组反应中参加反应的Cl2与 FeBr2的物质的量之比为1:2 | |
| C. | 第③组反应中生成1 mol Cl2,转移电子2 mol | |
| D. | 氧化性由强到弱顺序为MnO4->Cl2>Fe3+>Br2 |
分析 A.反应中KMnO4→MnSO4,Mn元素化合价由+7价降低为+2价,根据电子转移守恒,H2O2中氧元素化合价升高,应生成氧气,根据元素守恒还生成水.
B.由元素化合价可知,反应中只有亚铁离子被氧化,结合电子转移守恒计算判断.
C.由信息可知,MnO4-氧化Cl-为Cl2,Cl元素化合价由-1价升高为0价,转移电子的物质的量是氯气的2倍.
D.氧化剂氧化性强于氧化产物氧化性,由②可知Fe3+不能氧化Br-,氧化性Br2>Fe3+.
解答 解:A.反应中KMnO4→MnSO4,Mn元素化合价由+7价降低为+2价,根据电子转移守恒,H2O2中氧元素化合价升高,生成氧气,根据H元素守恒可知还生成水,故A正确;
B.由元素化合价可知,反应中只有亚铁离子被氧化,根据电子转移守恒2n(C12)=n(FeBr2),即n(C12):n(FeBr2)=1:2,故B正确;
C.由信息可知,MnO4-氧化Cl-为Cl2,Cl元素化合价由-1价升高为0价,转移电子的物质的量是氯气的2倍,生成1mo1C12,转移电子为2mo1,故C正确;
D.氧化剂氧化性强于氧化产物氧化性,由③可知氧化性MnO4->Cl2,由②可知氧化性Cl2>Fe3+,由②可知Fe3+不能氧化Br-,氧化性Br2>Fe3+,故D错误.
故选:D.
点评 本题考查氧化还原反应的守恒与计算、氧化性与还原性强弱比较,难度中等,注意氧化还原反应中的守恒运用判断未知物,侧重于考查学生的分析能力和对基础知识的应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.对于可逆反应N2+3H2?2NH3下列各项所表示的反应速率最快的是( )
| A. | ν(N2)=0.02 mol•L-1•s-1 | B. | ν(H2)=0.2 mol•L-1•s-1 | ||
| C. | ν(H2)=0.6 mol•L-1•min-1 | D. | ν(NH3)=1.2 mol•L-1•min-1 |
15.下列关于元素周期表和元素周期律的说法不正确的是( )
| A. | 元素周期表中前三周期为短周期 | |
| B. | 第IA族的元素不全是金属元素 | |
| C. | 元素性质呈现周期性变化的根本原因是元素的相对原子质量呈周期性变化 | |
| D. | 人类可以在周期表中金属与非金属的分界线处,寻找半导材料 |
12.把a、b、c、d四块金属片浸泡在稀硫酸中,用导线两两相连可以组成各种原电池.若a、b相连时,a为负极;c、d相连时,d上有气泡逸出;a、c相连时,a极减轻;b、d相连时,b为正极.则这四种金属活泼性顺序由强到弱的顺序为( )
| A. | a>b>c>d | B. | a>c>b>d | C. | a>c>d>b | D. | b>d>a>c |
19.下列化合物的结构中,只含有离子键的是( )
| A. | H2O | B. | NaCl | C. | NaOH | D. | CO2 |
9.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1mol 羟基(-OH)中电子数为9NA | |
| B. | 100 mL 2.0 mol•L-1的盐酸与醋酸溶液中氢离子数均为0.2NA | |
| C. | 将10.6 g Na2CO3固体溶于水,所得离子总数为0.3NA | |
| D. | 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA |
16.下列说法不正确的是( )
| A. | 明矾、漂白粉、臭氧的净水原理相同 | |
| B. | “血液透析”的原理利用了胶体的性质 | |
| C. | 食品包装中常放入有硅胶和铁粉的小袋,只能防止食物受潮 | |
| D. | 煤炭燃烧、机动车尾气、建筑扬尘等可加重雾霾. |
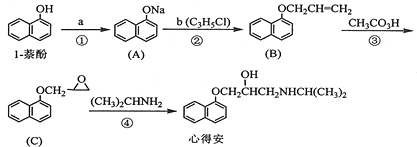
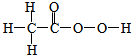 .
. ;由F生成一硝化产物的化学方程式为
;由F生成一硝化产物的化学方程式为 ,该产物的名称是2-硝基-1,4-苯二甲酸(或硝基对苯二甲酸).
,该产物的名称是2-硝基-1,4-苯二甲酸(或硝基对苯二甲酸).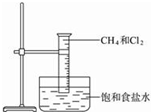 图是研究甲烷与氯气反应的实验装置图
图是研究甲烷与氯气反应的实验装置图