题目内容
9.设NA为阿伏加德罗常数的值,下列叙述正确的是( )| A. | 1mol 羟基(-OH)中电子数为9NA | |
| B. | 100 mL 2.0 mol•L-1的盐酸与醋酸溶液中氢离子数均为0.2NA | |
| C. | 将10.6 g Na2CO3固体溶于水,所得离子总数为0.3NA | |
| D. | 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA |
分析 A、-OH不显电性;
B、醋酸是弱电解质,在溶液中不能完全电离;
C、求出碳酸钠的物质的量,然后根据1mol碳酸钠中含2mol钠离子和1mol碳酸根;
D、氮气和CO的摩尔质量均为28g/mol,且两者均为双原子分子.
解答 解:A、-OH不显电性,故1mol氢氧根中含9NA个电子,故A正确;
B、醋酸是弱电解质,在溶液中不能完全电离,故醋酸溶液中的氢离子的个数小于0.2NA个,故B错误;
C、10.6g碳酸钠的物质的量为0.1mol,而1mol碳酸钠中含2mol钠离子和1mol碳酸根,故0.1mol碳酸钠中含0.3NA个离子,而溶于水后由于碳酸根会水解,导致离子个数增多,故溶液中的离子个数大于0.3NA个,故C错误;
D、氮气和CO的摩尔质量均为28g/mol,故14g混合物的物质的量为0.5mol,且两者均为双原子分子,故0.5mol混合物中含NA个原子,故D正确.
故选AD.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
19.某元素构成的双原子单质分子有三种,其式量分别为158、160、162.在天然单质中,此三种单质的物质的量之比为1:1:1,由此推断以下结论中,正确的是( )
| A. | 此元素有三种同位素 | |
| B. | 其中一种同位素质量数为80 | |
| C. | 其中质量数为79的同位素原子占原子总数的$\frac{1}{3}$ | |
| D. | 此元素的单质的平均式量为160 |
17.用括号内试剂除去下列各物质中的少量杂质,正确的是( )
| A. | 溴苯中的溴(苯) | B. | 甲烷中的乙烯(溴水) | ||
| C. | 乙醇中的水(金属钠) | D. | 甲烷中的乙烯(酸性高锰酸钾溶液) |
4.根据表中信息判断,下列选项不正确的是( )
| 序号 | 反应物 | 产物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4 |
| ② | Cl2、FeBr2 | FeCl3、FeBr3 |
| ③ | MnO4- | Cl2、Mn2+ |
| A. | 第①组反应的其余产物为H2O和 O2 | |
| B. | 第②组反应中参加反应的Cl2与 FeBr2的物质的量之比为1:2 | |
| C. | 第③组反应中生成1 mol Cl2,转移电子2 mol | |
| D. | 氧化性由强到弱顺序为MnO4->Cl2>Fe3+>Br2 |
1.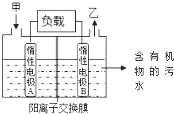 一种处理污水的燃料电池模型如图所示.该电池工作时,只需把污水注入反应池,细菌就可将污水中的有机物分解,在此过程中释放出电子、质子和乙.下列叙述不正确的是( )
一种处理污水的燃料电池模型如图所示.该电池工作时,只需把污水注入反应池,细菌就可将污水中的有机物分解,在此过程中释放出电子、质子和乙.下列叙述不正确的是( )
 一种处理污水的燃料电池模型如图所示.该电池工作时,只需把污水注入反应池,细菌就可将污水中的有机物分解,在此过程中释放出电子、质子和乙.下列叙述不正确的是( )
一种处理污水的燃料电池模型如图所示.该电池工作时,只需把污水注入反应池,细菌就可将污水中的有机物分解,在此过程中释放出电子、质子和乙.下列叙述不正确的是( )| A. | B电极为正极 | |
| B. | 气体乙可能为CO2 | |
| C. | O2在A电极得电子 | |
| D. | 电池工作时,B电极附近的pH逐渐减小 |
18.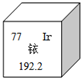 2014年5月7日,天津某工程检测公司在进行探伤作业期间,一枚黄豆粒大小的放射源铱-192丢失,造成了严重的安全事故,图示是铱在元素周期表中的信息,下列说法正确的是( )
2014年5月7日,天津某工程检测公司在进行探伤作业期间,一枚黄豆粒大小的放射源铱-192丢失,造成了严重的安全事故,图示是铱在元素周期表中的信息,下列说法正确的是( )
 2014年5月7日,天津某工程检测公司在进行探伤作业期间,一枚黄豆粒大小的放射源铱-192丢失,造成了严重的安全事故,图示是铱在元素周期表中的信息,下列说法正确的是( )
2014年5月7日,天津某工程检测公司在进行探伤作业期间,一枚黄豆粒大小的放射源铱-192丢失,造成了严重的安全事故,图示是铱在元素周期表中的信息,下列说法正确的是( )| A. | 铱的相对原子质量为192.2克 | |
| B. | 铱原子核内的中子数为77 | |
| C. | K2IrO3中Ir的化合价为+4 | |
| D. | 生活中常用的铱金笔为纯净的铱单质 |
19.短周期主族元素A、B、C、D的原子序数依次增大.已知A、C的原子序数之差为8,A、B、C三种元素原子的最外层电子数之和为15,B元素原子的最外层电子数等于A元素原子的最外层电子数的一半,下列叙述正确的是( )
| A. | 简单离子的半径:B>C>D>A | |
| B. | 氢化物的稳定性:C>D | |
| C. | B和其他3种元素均能形成离子化合物 | |
| D. | B与D形成的化合物溶于水所得溶液显酸性 |
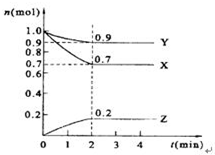 某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.
 .
. 的路线:
的路线:

