题目内容
16.下列关于原电池的叙述中正确的是( )| A. | 正极和负极必须是两种不同的金属 | |
| B. | 电子流入的一极为正极 | |
| C. | 原电池工作时,正极和负极上发生的都是氧化还原反应 | |
| D. | 原电池工作时,实现了将电能转化为化学能 |
分析 将化学能转变为电能的装置是原电池,其电极材料是两种活泼性不同的金属或导电的非金属,负极上发生氧化反应,正极上发生还原反应,电子从负极流向正极.
解答 解:A.原电池的两极可能的由导电的非金属组成,如氢氧燃料电池中用石墨作电极材料,故A错误;
B.原电池放电时,电子从负极流向正极,故B正确;
C.原电池的负极上失电子发生氧化反应,正极上得电子发生还原反应,故C错误;
D.原电池是向外提供电能的装置,将化学能转变为电能,故D错误;
故选B.
点评 本题考查原电池原理,题目难度不大,注意原电池的电极材料不一定都是金属,且不一定是较活泼的金属作负极,如镁、铝和氢氧化钠溶液构成的原电池中,铝作负极,为易错点.

练习册系列答案
相关题目
7.下列化学用语中正确的是( )
| A. | 乙烯的结构简式为CH2CH2 | B. | 羟基的电子式: | ||
| C. | 丁烯的键线式 | D. | 乙醇的分子式:CH3CH2OH |
4.下列化合物分子中的所有碳原子不能处于同一平面的是( )
| A. | 乙烯 | B. | 丙炔 | C. | 异戊烷 | D. | 对二甲苯 |
11.工业上用异丙苯氧化法合成苯酚,其生产流程如下图:
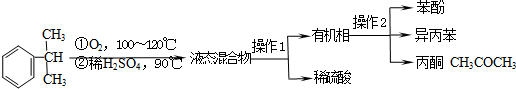
有关物质的性质如表:
(1)“操作2”的名称是分馏或蒸馏.
(2)丙酮中常含有苯酚和异丙苯中的一种或者两种有机物杂质,某同学做了如下检验.
(3)为测定某工厂排放的污水中苯酚的含量,进行如下实验:取污水试样10.00mL加水稀释至100mL,加入10.0mL一定浓度的KBrO3和KBr的混合溶液,立即加入5mL盐酸,摇匀后加入1gKI固体(足量),再摇匀,放置5min.用0.01000mol/LNa2S2O3标准溶液滴定至淡黄色,加入1mL淀粉溶液,继续滴定至蓝色刚好褪去,用去Na2S2O3标准溶液14.46mL;同时以水代替污水试样做对比实验,用去Na2S2O3标准溶液38.46mL.已知上述实验中发生的反应有:KBrO3+5KBr+6HCl=3Br2+3H2O+6KCl 2Na2S2O3+I2=Na2S4O6+2NaI,则此污水中苯酚的含量376.0mg/L.(以mg/L表示,苯酚的相对分子质量为94)

有关物质的性质如表:
| 物质 | 沸点 | 溶解性 | 主要化学性质 |
| 异丙苯 | 152.4℃ | 不溶于水,易溶于酒精. | 可被强氧化剂氧化 |
| 苯酚 | 181.8℃ | 微溶于冷水,易溶于热水 和酒精等有机溶剂. | 易被氧化 |
| 丙酮 | 56.2℃ | 易溶于水和有机溶剂 | 不易被氧化 |
(2)丙酮中常含有苯酚和异丙苯中的一种或者两种有机物杂质,某同学做了如下检验.
| 检验项目 | 实验方案 |
| 检验丙酮中一定存在有机 杂质的试剂是①A.(填写右边字母) | A.酸性KMnO4溶液,加热 B.乙醇,溶解 C.NaOH溶液(酚酞),加热 |
| 检验丙酮中一定含有苯 酚的方案: | 取少许待测液置于试管中,滴加1~2滴FeCl3溶液,若试管中溶液颜色变为②紫色,则丙酮中含有苯酚,反之则没有. |
8.下列有关物质的量的说法中,正确的是( )
| A. | Fe的摩尔质量为56g | |
| B. | 常温常压下,71gCl2含有NA个Cl2分子 | |
| C. | 1mol O2在常温下的体积都为22.4L | |
| D. | 将1molNaCl晶体加入到1L水中,得到NaCl溶液的浓度就是1mol•L-1 |
5.取四等份铝,分别加入足量的下列溶液中,充分反应后,放出氢气最多的是( )
| A. | 3 mol•L-1氨水 | B. | 4 mol•L-1 HNO3 | ||
| C. | 8 mol•L-1 NaOH | D. | 18 mol•L-1 H2SO4 |
6.用酸性氢氧燃料电池电解饱和食盐水的装置如图所示 (a、b为石墨电极).下列说法中,正确的是( )
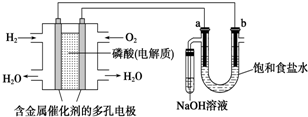

| A. | 电池工作时,正极反应式为:O2+2 H2O+4e-=4OH- | |
| B. | 忽略能量损耗,当电池中消耗0.1g H2时,b极周围会产生1.12L H2 | |
| C. | 电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极 | |
| D. | 电解时,a 电极周围首先放电的是Cl- |
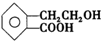 ,它可通过不同化学反应分别制得B、C、D和E四种物质.
,它可通过不同化学反应分别制得B、C、D和E四种物质.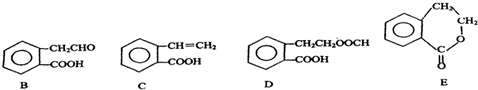
 .
. +2NaOH→
+2NaOH→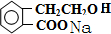 +HCOONa+H2O.
+HCOONa+H2O. .
.