题目内容
18.下列装置可用于NH4Cl固体和Ca(OH)2固体实验室制NH3的实验,能达到实验目的装置的是( )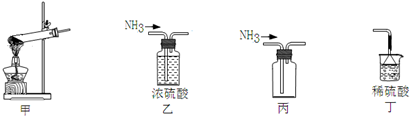
| A. | 用甲做发生装置 | B. | 用乙除去NH3中的杂质 | ||
| C. | 用丙来收集NH3 | D. | 用丁进行尾气处理并防止倒吸 |
分析 用于NH4Cl固体和Ca(OH)2固体实验室制NH3的实验,为固体与固体加热制取气体的原理,因有水生成,则试管口要略向下倾斜,氨气可利用向下排空气法收集,处理尾气时要防止倒吸,以此来解答.
解答 解:A.用甲做发生装置,试管口要略向下倾斜,故A错误;
B.氨气与浓硫酸反应,则不能用乙除去NH3中的杂质,故B错误;
C.氨气可利用向下排空气法收集,而丙中为向上排空气法,故C错误;
D.氨气极易溶于稀硫酸,易发生倒吸,则用丁(倒扣的漏斗)进行尾气处理并防止倒吸,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握氨气的制备实验原理、实验装置的作用及实验技能等为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
20.酯X与奎宁酸(结构简述如图)互为同分异构体,酯X水解得到2molHCOOH和1mol醇Y,醇Y的分子式为( )

| A. | C4H10O3 | B. | C5H12O4 | C. | C4H12O4 | D. | C5H12O5 |
10.从理论上分析,关于Fe-CuSO4溶液-Cu原电池的叙述正确的是( )
| A. | 铜极为负极 | B. | 电子从铜沿导线转移到铁 | ||
| C. | 铁表面析出金属铜 | D. | 总反应为Fe+CuSO4=FeSO4+Cu |
7.下列化学用语中正确的是( )
| A. | 乙烯的结构简式为CH2CH2 | B. | 羟基的电子式: | ||
| C. | 丁烯的键线式 | D. | 乙醇的分子式:CH3CH2OH |
8.下列有关物质的量的说法中,正确的是( )
| A. | Fe的摩尔质量为56g | |
| B. | 常温常压下,71gCl2含有NA个Cl2分子 | |
| C. | 1mol O2在常温下的体积都为22.4L | |
| D. | 将1molNaCl晶体加入到1L水中,得到NaCl溶液的浓度就是1mol•L-1 |