题目内容
17.以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeC13•6H2O)的工艺流程如图1: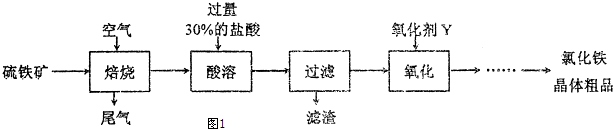
请按要求回答下列问题:
(1)需将硫铁矿粉碎再焙烧的目的是增大反应物的接触面积,加快反应速率.
(2)酸溶及后续过程中均需保持盐酸过量,其目的是提高铁元素的浸出率、抑制Fe3+水解.
(3)氧化剂Y可以是Cl2或H2O2,其各自的优点是用氯气氧化原子利用率高、用H2O2氧化无污染且不引入新杂质.
(4)尾气主要含N2、O2、气体Z和少量的CO2、H2O.取标准状况下的VL尾气测定其中气体Z含量的方案如下:
【方案一】:将尾气缓慢通过如图2装置A中:
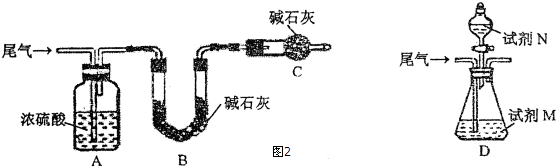
①C仪器的名称是干燥管,该装置的作用是防止空气中的水蒸气、CO2被B装置吸收.
②实验时先通入尾气,再通入一定量氮气,通过B装置的增重来测量气体Z的体积分数,请写出该方案合理与否的理由该方案不合理,因为尾气中的CO2也能被B装置中的碱石灰吸收,致使所测气体Z即二氧化硫的体积分数偏大.
【方案二】:将尾气缓慢通过如上装置D中,充分与足量试剂M反应后,再滴入过量试剂N,经过滤、洗涤、干燥、称量,得沉淀质量为mg.
③若试剂M、N分别是溴水、BaCl2溶液,写出方案二涉及反应的离子方程式:SO2+Br2+2H2O=SO42-+2Br-+4H+、Ba2++SO42-=BaSO4↓.
写出气体Z的体积百分含量的表达式是(用含m、V的代数式表示)$\frac{2240m}{233V}$%.
④若试剂M、N分别是NaHCO3溶液、BaCl2溶液,所得沉淀的化学式为BaSO3.
⑤若试剂M是Ba(NO3)2溶液,不再滴加试剂N,观察到D中生成的无色气体在瓶口处变为红棕色.写出溶液中反应的离子方程式:3SO2+3Ba2++2NO3-+2H2O=3BaSO4+2NO↑+4H+.
分析 硫铁矿在空气中焙烧,发生的反应为4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,将得到的固体酸溶,发生的反应为
Fe2O3+6HCl=2FeCl3+3H2O,然后过滤,向滤液中加入氧化剂X将亚铁离子氧化生成铁离子,不能移入新杂质,可以是氯气或过氧化氢,然后将溶液蒸发浓缩、冷却结晶、过滤得到晶体FeCl3•6H2O,过量的盐酸可以抑制铁离子水解.
(1)将硫铁矿粉碎,增大反应物的接触面积;
(2)加入过量的酸,提高铁元素的浸出率,抑制Fe3+水解;
(3)用氯气氧化原子利用率高;用H2O2氧化无污染且不引入新杂质;
(4)①仪器C为干燥管,吸收空气中的水蒸气、CO2,防止被B装置吸收;
②尾气中的CO2也能被B装置中的碱石灰吸收,二氧化硫的体积分数偏大;
③若试剂M、N分别是溴水、BaCl2溶液,溴与二氧化硫在溶液中反应生成硫酸与HBr,硫酸与氯化钡反应生成硫酸钡与HCl;
沉淀mg为硫酸钡的质量,根据S原子守恒计算二氧化硫的体积,进而计算二氧化硫的体积百分含量;
④若试剂M、N分别是NaHCO3溶液、BaCl2溶液,二氧化硫与碳酸氢钠在溶液中反应生成亚硫酸钠,亚硫酸钠与氯化钡反应生成亚硫酸钡;
⑤若试剂M是Ba(NO3)2溶液,不再滴加试剂N,二氧化硫溶于水呈酸性,酸性条件下硝酸根具有强氧化性,将亚硫酸氧化为硫酸,硫酸反应生成硫酸钡沉淀,硝酸根被还原为NO.
解答 解:硫铁矿在空气中焙烧,发生的反应为4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,将得到的固体酸溶,发生的反应为
Fe2O3+6HCl=2FeCl3+3H2O,然后过滤,向滤液中加入氧化剂X将亚铁离子氧化生成铁离子,不能移入新杂质,可以是氯气或过氧化氢,然后将溶液蒸发浓缩、冷却结晶、过滤得到晶体FeCl3•6H2O,过量的盐酸可以抑制铁离子水解.
(1)将硫铁矿粉碎再焙烧的目的是:增大反应物的接触面积,加快反应速率,
故答案为:增大反应物的接触面积,加快反应速率;
(2)加入过量的酸,提高铁元素的浸出率,抑制Fe3+水解,
故答案为:提高铁元素的浸出率;抑制Fe3+水解;
(3)加入氧化剂将亚铁离子氧化为铁离子,不能移入新杂质,氧化剂Y可以是Cl2或H2O2,其各自的优点是:用氯气氧化原子利用率高,用H2O2氧化无污染且不引入新杂质,
故答案为:H2O2;用氯气氧化原子利用率高;用H2O2氧化无污染且不引入新杂质;
(4)①仪器C为干燥管,吸收空气中的水蒸气、CO2,防止被B装置吸收,避免影响二氧化硫测定,
故答案为:干燥管;防止空气中的水蒸气、CO2被B装置吸收;
②尾气中的CO2也能被B装置中的碱石灰吸收,致使所测气体Z即二氧化硫的体积分数偏大,该实验方案不合理,
故答案为:该方案不合理,因为尾气中的CO2也能被B装置中的碱石灰吸收,致使所测气体Z即二氧化硫的体积分数偏大,
③若试剂M、N分别是溴水、BaCl2溶液,溴与二氧化硫在溶液中反应生成硫酸与HBr,硫酸与氯化钡反应生成硫酸钡与HCl,反应离子方程式为:SO2+Br2+2H2O=SO42-+2Br-+4H+、Ba2++SO42-=BaSO4↓,
沉淀mg为硫酸钡的质量,根据S原子守恒,二氧化硫的体积为$\frac{mg}{233g/mol}$×22.4L/mol=$\frac{22.4m}{233}$L,二氧化硫的体积百分含量为$\frac{\frac{22.4m}{233}L}{VL}$×100%=$\frac{2240m}{233V}$%,
故答案为:SO2+Br2+2H2O=SO42-+2Br-+4H+、Ba2++SO42-=BaSO4↓;$\frac{2240m}{233V}$%;
④若试剂M、N分别是NaHCO3溶液、BaCl2溶液,二氧化硫与碳酸氢钠在溶液中反应生成亚硫酸钠,亚硫酸钠与氯化钡反应生成亚硫酸钡,所得沉淀为:BaSO3,
故答案为:BaSO3;
⑤若试剂M是Ba(NO3)2溶液,不再滴加试剂N,二氧化硫溶于水呈酸性,酸性条件下硝酸根具有强氧化性,将亚硫酸氧化为硫酸,硫酸反应生成硫酸钡沉淀,硝酸根被还原为NO,反应中离子方程式为:3SO2+3Ba2++2NO3-+2H2O=3BaSO4+2NO↑+4H+,
故答案为:3SO2+3Ba2++2NO3-+2H2O=3BaSO4+2NO↑+4H+.
点评 本题考查物质准备工艺流程、物质含量测定、对试剂的分析评价、实验方案评价、离子方程式书写等,熟练掌握元素化合物性质,是对对学生综合能力的考查.

| A. | H2SiO3 | B. | HClO4 | C. | H2SO4 | D. | H2CO3 |

| A. | C4H10O3 | B. | C5H12O4 | C. | C4H12O4 | D. | C5H12O5 |
| A. | 乙烯的结构简式为CH2CH2 | B. | 羟基的电子式: | ||
| C. | 丁烯的键线式 | D. | 乙醇的分子式:CH3CH2OH |
 (I)、某学生用0.100mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
(I)、某学生用0.100mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步: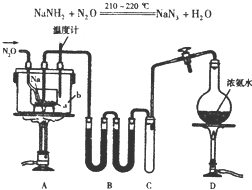 NaN3(叠氮化钠)是一种易溶于水的白色晶体,微溶于乙醇,不溶于乙醚,常用作汽车安全气囊中的药剂.实验室制取叠氮化钠的原理、实验装置及步骤如下:
NaN3(叠氮化钠)是一种易溶于水的白色晶体,微溶于乙醇,不溶于乙醚,常用作汽车安全气囊中的药剂.实验室制取叠氮化钠的原理、实验装置及步骤如下: