题目内容
12.下列化学方程式或离子方程式正确的是( )| A. | Cu与S加热反应:Cu+S$\frac{\underline{\;\;△\;\;}}{\;}$CuS | |
| B. | 向氯化氨的稀溶液中加入少量NaOH:NH${\;}_{4}^{+}$+OH=NH3↑+H2O | |
| C. | 向(NH4)2SO4溶液中加入适量Ba(OH)2:Ba2++SO${\;}_{4}^{2-}$=BaSO4↓ | |
| D. | SO2气体通入溴水中:SO2+Br2+2H2O=2Br-+SO${\;}_{4}^{2-}$+4H+ |
分析 A.铜与硫单质加热反应生成的是硫化亚铜;
B.稀的氯化铵溶液中加入氢氧化钠,反应生成的是一水合氨;
C.漏掉了铵根离子与氢氧根离子的反应;
D.二者发生氧化还原反应生成硫酸和溴化氢.
解答 解:A.Cu与S加热反应生成硫化亚铜,正确的化学方程式为:2Cu+S$\frac{\underline{\;\;△\;\;}}{\;}$Cu2S,故A错误;
B.向氯化氨的稀溶液中加入少量NaOH,反应生成一水合氨和氯化钠,正确的离子方程式为:NH4++OH-=NH3•H2O,故B错误;
C.向(NH4)2SO4溶液中加入适量Ba(OH)2,反应生成硫酸钡沉淀和一水合氨,正确的离子方程式为:2NH4++2OH-+Ba2++SO42-=BaSO4↓+2NH3•H2O,故C错误;
D.SO2气体通入溴水中,二者发生氧化还原反应,反应的离子方程式为:SO2+Br2+2H2O=2Br-+SO42-+4H+,故D正确;
故选D.
点评 本题考查了离子方程式的判断,题目难度不大,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
相关题目
13.下列物质的水溶液因水解显酸性的是( )
| A. | CH3COONa | B. | KCl | C. | NaHSO4 | D. | NH4Cl |
20.元素周期律和周期表揭示了元素之间的内在联系,反映了元素性质与它的原子结构的关系.下列有关性质的大小关系符合元素周期律的是( )
| A. | 酸性:HNO3>H3BO3>H2CO3 | B. | 稳定性:HF>PH3>H2O | ||
| C. | 碱性:Be(OH)2>Mg(OH)2>Ca(OH)2 | D. | 金属性:K>Mg>Al |
7.短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的简单气态氢化物的水溶液呈碱性,乙位于第ⅤA族,甲和丙同主族,丁的最外层电子数和电子层数相等,下列说法正确的是( )
| A. | 金属性:丙>甲 | |
| B. | 原子半径:r(丁)>r(丙)>r(乙)>r(甲) | |
| C. | 乙、丙、丁的简单离子的电子层结构相同 | |
| D. | 甲和乙以1:4形成的简单阳离子含11个电子 |
17.0.10mol/L乙酸溶液的pH值为(已知KHAC=1.8×10-5)( )
| A. | 2.7 | B. | 2.87 | C. | 2.75 | D. | 5.7 |
4.有机物甲、乙的结构如图所示,下列说法错误的是( )
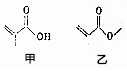

| A. | 甲、乙互为同分异构体 | |
| B. | 甲、乙都能发生取代、加成和水解反应 | |
| C. | 甲、乙都能使酸性的高锰酸钾褪色 | |
| D. | 等物质的量的甲和乙与足量的NaOH溶液反应,消耗NaOH的物质的量相等 |
1.已知:CH3CH2CH2CH3(g)+$\frac{13}{2}$O2(g)=4CO2(g)+5H2O(l)△H=-2878kJ•mol-1
(CH3)2CHCH3(g)+$\frac{13}{2}$O2(g)=4CO2(g)+5H2O(l)△H=-2869kJ•mol-1.
下列说法正确的是( )
(CH3)2CHCH3(g)+$\frac{13}{2}$O2(g)=4CO2(g)+5H2O(l)△H=-2869kJ•mol-1.
下列说法正确的是( )
| A. | 正丁烷分子储存的能量小于异丁烷 | |
| B. | 正丁烷的稳定性大于异丁烷 | |
| C. | 异丁烷转化为正丁烷的过程是一个放热过程 | |
| D. | 异丁烷转化为正丁烷的过程是一个吸热过程 |
2.以下物质的工业制备所用主要原料(括号内物质)不符合事实的是( )
| A. | 碘(海带) | B. | 溴(晒盐后的卤水) | C. | 乙烯(乙醇) | D. | 烧碱(氯化钠) |
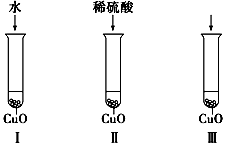 氧化铜是一种黑色固体,可溶于稀硫酸.某同学想知道是稀硫酸的哪种粒子(H2O、H+、SO42-)能使氧化铜溶解.请你和他一起通过如图所示Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动.
氧化铜是一种黑色固体,可溶于稀硫酸.某同学想知道是稀硫酸的哪种粒子(H2O、H+、SO42-)能使氧化铜溶解.请你和他一起通过如图所示Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动.