题目内容
2.以下物质的工业制备所用主要原料(括号内物质)不符合事实的是( )| A. | 碘(海带) | B. | 溴(晒盐后的卤水) | C. | 乙烯(乙醇) | D. | 烧碱(氯化钠) |
分析 A.海带中含碘元素;
B.海水晒盐后的溶液中含NaBr;
C.工业制备乙烯是利用石油的裂解得到;
D.电极饱和食盐水得到氢氧化钠溶液.
解答 解:A.海带中含碘元素,利用氧化还原反应及萃取可提纯碘,故A正确;
B.海水晒盐后的余液中含NaBr,利用氧化还原反应及萃取可提纯溴,故B正确;
C.工业制备乙烯是利用石油的裂解得到,乙醇是实验室制取乙烯的方法,故C错误;
D.电解饱和食盐水生成氯气、氢气和氢氧化钠溶液,是工业制备烧碱的方法,故D正确;
故选C.
点评 本题考查了海水资源的综合应用,掌握物质的实验室制备和工业制备原理的理解应用,掌握基础是解题关键,题目较简单.

练习册系列答案
相关题目
12.下列化学方程式或离子方程式正确的是( )
| A. | Cu与S加热反应:Cu+S$\frac{\underline{\;\;△\;\;}}{\;}$CuS | |
| B. | 向氯化氨的稀溶液中加入少量NaOH:NH${\;}_{4}^{+}$+OH=NH3↑+H2O | |
| C. | 向(NH4)2SO4溶液中加入适量Ba(OH)2:Ba2++SO${\;}_{4}^{2-}$=BaSO4↓ | |
| D. | SO2气体通入溴水中:SO2+Br2+2H2O=2Br-+SO${\;}_{4}^{2-}$+4H+ |
10.下列实验操作和理象、结论均正确且有因果关系的是( )
| 选项 | 实验操作和现象 | 结论 |
| A | 向某溶液中滴加CCl4,振荡、静置,下层溶液显紫色 | 原溶液中含有I- |
| B | 常温下,0.1mol/LNaHSO3溶液的pH约为5 | HSO3-的电离程度大于其水解程度 |
| C | 相同温度下,测得饱和亚硫酸溶液的pH小于饱和碳酸溶液的pH | 亚硫酸的酸性强于碳酸 |
| D | 向稀HNO3中加入过量的Fe粉,充分反应后,滴入KSCN溶液不显红色 | 稀HNO3将Fe氧化为Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
17.物质在下列应用中,利用了其还原性的是( )
| A. | 纯碱去油污 | B. | 明矾净水 | C. | 铝冶炼金属 | D. | 漂粉精漂白织物 |
7.下列化学反应所对应的离子方程式书写正确的是( )
| A. | 醋酸铵与稀盐酸反应:CH3COONH4+H+→CH3COOH+NH4+ | |
| B. | 氯化铁溶液中通入硫化氢气体:2Fe3++S2-→2Fe2++S↓ | |
| C. | 硫酸铜溶液中加入过量的氢氧化钡:Ba2++SO42-→BaSO4↓ | |
| D. | 溴化亚铁溶液中通入足量的氯气:3Cl2+2Fe2++4Br-→6Cl-+2Fe3++2Br2 |
14.化学与社会、生活密切相关.下列说法正确的是( )
| A. | 稀豆浆、食盐水均可产生丁达尔效应 | |
| B. | 利用生物质能就是间接利用太阳能 | |
| C. | 钢铁在潮湿的空气中主要发生化学腐蚀 | |
| D. | 纯铝质轻,耐腐蚀性强,可直接用作航天材料 |
11.NA为阿伏伽德罗常数,下列说法正确的是( )
| A. | 100mL12Lmol•L-1浓盐酸与足量MnO2共热,转移的电子数为0.6NA | |
| B. | 1mol•L-1的NaClO溶液中含有ClO-的数目为小于NA | |
| C. | 标准状况下,22.4LNO和11.2LO2混合后气体的分子总数为NA | |
| D. | O2和O3的混合物共3.2g,其中所含氧原子数一定为0.2NA |
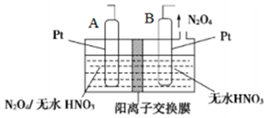 氮的氧化物种类较多,有N2O、NO、N2O3、NO2、N2O4、N2O5等,他们应用广泛.
氮的氧化物种类较多,有N2O、NO、N2O3、NO2、N2O4、N2O5等,他们应用广泛.