题目内容
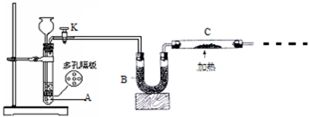 某化学课外活动小组拟用Zn和稀H2SO4制取H2还原CuO,实验装置如图.
某化学课外活动小组拟用Zn和稀H2SO4制取H2还原CuO,实验装置如图.(1)按图连接好实验装置.检查装置的气密性,方法是
(2)A中反应的化学方程式为
(3)加热C处酒精灯之前必须进行的操作是(答详细的操作过程)
(4)C中固体加热前质量为mg,加热后质量为ng,则实验中实际消耗的H2质量为
A.=(m-n)/8 B.=m/40 C.=n/32 D.>(m-n)/8.
考点:性质实验方案的设计
专题:实验设计题
分析:实验时,应首先检验装置的气密性,Zn和稀H2SO4在A中发生反应生成氢气,经B中碱石灰干燥后在加热条件下与CuO发生氧化还原反应生成Cu和水,为防止不纯的氢气在加热时爆炸,应先通入氢气,将装置内的空气排出,应停止加热后继续通入氢气,防止铜被氧化而影响实验结果,以此解答该题.
解答:
解:(1)A装置有长颈漏斗,检查气密性时可关闭活塞K,向长颈漏斗中加水,待水淹没长颈漏斗下端管口,继续加水出现稳定液面差,则装置气密性良好,
故答案为:关闭活塞K,向长颈漏斗中加水,待水淹没长颈漏斗下端管口,继续加水出现稳定液面差,则装置气密性良好;
(2)Zn和稀H2SO4在A中发生反应生成氢气,方程式为Zn+H2SO4=ZnSO4+H2,在C中发生H2+CuO
Cu+H2O,反应中Cu元素化合价降低,被还原,CuO为氧化剂,氢气为还原剂,在加热条件下反应,为保证反应顺利进行,避免温度过低,氢气在反应前应先干燥,B用于除去H2中混有的水蒸气,
故答案为:Zn+H2SO4=ZnSO4+H2;CuO;除去H2中混有的水蒸气;
(3)为防止不纯的氢气在加热时爆炸,应先通入氢气,将装置内的空气排出,应先验纯,可用向下排空法收集一小试管气体,大拇指堵住,管口朝下靠近酒精灯火焰,若产生尖锐的爆鸣声则不纯,若“噗”的声音则气体已纯,
故答案为:用向下排空法收集一小试管气体,大拇指堵住,管口朝下靠近酒精灯火焰,若产生尖锐的爆鸣声则不纯,若“噗”的声音则气体已纯;
(4)C中固体加热前质量为mg,加热后质量为ng,则由方程式H2+CuO
Cu+H2O可知,减少的质量为O元素的质量,n(CuO)=n(O)=
mol,则需反应氢气的物质的量为
mol,质量为
g,因为防止不纯的氢气在加热时爆炸,应先通入氢气,将装置内的空气排出,应停止加热后继续通入氢气,防止铜被氧化而影响实验结果,则通入氢气的质量应大于
g,故答案为:D.
故答案为:关闭活塞K,向长颈漏斗中加水,待水淹没长颈漏斗下端管口,继续加水出现稳定液面差,则装置气密性良好;
(2)Zn和稀H2SO4在A中发生反应生成氢气,方程式为Zn+H2SO4=ZnSO4+H2,在C中发生H2+CuO
| ||
故答案为:Zn+H2SO4=ZnSO4+H2;CuO;除去H2中混有的水蒸气;
(3)为防止不纯的氢气在加热时爆炸,应先通入氢气,将装置内的空气排出,应先验纯,可用向下排空法收集一小试管气体,大拇指堵住,管口朝下靠近酒精灯火焰,若产生尖锐的爆鸣声则不纯,若“噗”的声音则气体已纯,
故答案为:用向下排空法收集一小试管气体,大拇指堵住,管口朝下靠近酒精灯火焰,若产生尖锐的爆鸣声则不纯,若“噗”的声音则气体已纯;
(4)C中固体加热前质量为mg,加热后质量为ng,则由方程式H2+CuO
| ||
| m-n |
| 16 |
| m-n |
| 16 |
| m-n |
| 8 |
| m-n |
| 8 |
点评:本题考查性质实验的设计,侧重于学生的分析能力、实验能力和计算能力的考查,为高频考点,注意把握实验的原理和注意事项,难度不大.

练习册系列答案
相关题目
将1molSO2和1molO2通入一容积不变的密闭容器中,在一定温度和催化剂作用下发生反应 SO2(g)+
O2(g)?SO3(g).达到平衡后SO3为0.3mol,此时若移走0.5molSO2和0.5mol O2,则重新达到平衡后SO3物质的量为( )
| 1 |
| 2 |
| A、等于0.3mol |
| B、等于0.15mol |
| C、小于0.15mol |
| D、大于0.15mol,小于0.3mol |
 (1)已知:①Fe(s)+
(1)已知:①Fe(s)+
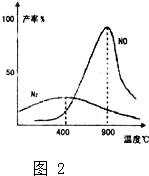
 (1)在1L密闭容器内,800℃时发生反应:2NO(g)+O2(g)?2N02(g)△H<0,容器内各物质的浓度变化如图1所示.
(1)在1L密闭容器内,800℃时发生反应:2NO(g)+O2(g)?2N02(g)△H<0,容器内各物质的浓度变化如图1所示. 为了适应“低碳生活”,某化学兴趣小组用铝制废牙膏皮、一大一小两种试管和稀硫酸来制取并收集一试管氢气.据此完成下列要求.
为了适应“低碳生活”,某化学兴趣小组用铝制废牙膏皮、一大一小两种试管和稀硫酸来制取并收集一试管氢气.据此完成下列要求.