题目内容
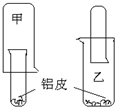 为了适应“低碳生活”,某化学兴趣小组用铝制废牙膏皮、一大一小两种试管和稀硫酸来制取并收集一试管氢气.据此完成下列要求.
为了适应“低碳生活”,某化学兴趣小组用铝制废牙膏皮、一大一小两种试管和稀硫酸来制取并收集一试管氢气.据此完成下列要求.(1)设计的装置比较合理的学生是
(2)用较合理的装置制取氢气,要使氢气充满收集氢气的试管,应采取的措施是
(3)写出生成氢气的离子方程式:
考点:实验装置综合
专题:实验题
分析:(1)氢气的密度比空气小,乙装置难以收集到氢气;
(2)氢气要充满试管,应保证将空气排除,以此进行操作;
(3)铝和稀硫酸反应生成硫酸铝和氢气;结合化合价的变化解答.
(2)氢气要充满试管,应保证将空气排除,以此进行操作;
(3)铝和稀硫酸反应生成硫酸铝和氢气;结合化合价的变化解答.
解答:
解:(1)氢气的密度比空气小,如用乙装置,则生成的氢气易从试管外逸出,且不易排除试管内的空气,故答案为:甲;
(2)氢气要充满试管,应保证将空气排除,可先将小试管贴近大试管底部,随着气泡的生成,慢慢将小试管向下降或将大试管向上升高,
故答案为:先将小试管贴近大试管底部,随着气泡的生成,慢慢将小试管向下降或将大试管向上升高;
(3))铝和稀硫酸反应生成硫酸铝和氢气,反应的离子方程式为2Al+6H+═2Al3++3H2↑,反应中Al元素化合价由0价升高到+3价,则消耗1mol铝转移的电子的物质的量为3mol,H元素化合价由+1价降低到0价,被还原,硫酸为氧化剂,还原产物为H2,
故答案为:2Al+6H+═2Al3++3H2↑;3mol; 硫酸;H2.
(2)氢气要充满试管,应保证将空气排除,可先将小试管贴近大试管底部,随着气泡的生成,慢慢将小试管向下降或将大试管向上升高,
故答案为:先将小试管贴近大试管底部,随着气泡的生成,慢慢将小试管向下降或将大试管向上升高;
(3))铝和稀硫酸反应生成硫酸铝和氢气,反应的离子方程式为2Al+6H+═2Al3++3H2↑,反应中Al元素化合价由0价升高到+3价,则消耗1mol铝转移的电子的物质的量为3mol,H元素化合价由+1价降低到0价,被还原,硫酸为氧化剂,还原产物为H2,
故答案为:2Al+6H+═2Al3++3H2↑;3mol; 硫酸;H2.
点评:本题综合考查气体的制备以及氧化还原反应等知识,侧重于学生的分析能力和实验能力的考查,难度不大,注意把握实验的原理.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
下列有关工业生产的叙述正确的是( )
| A、合成氨工业中,将NH3及时液化分离有利于加快反应速率 |
| B、硫酸工业中,接触室内安装热交换器是为了利用SO3转化为H2SO4时放出的热量 |
| C、氯碱工业中,使用离子交换膜可防止C12和NaOH溶液反应 |
| D、电镀工业中,必需将镀件与电源的负极相连 |
下列的分离方法不正确的是( )
| A、用酒精萃取碘水中的碘 |
| B、用蒸馏的方法将自来水制成蒸馏水 |
| C、用盐酸除去铜中混有的锌 |
| D、用淘洗的方法从沙里淘金 |
 某化学课外活动小组拟用Zn和稀H2SO4制取H2还原CuO,实验装置如图.
某化学课外活动小组拟用Zn和稀H2SO4制取H2还原CuO,实验装置如图.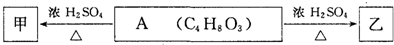
 实验室用如图所示装置A、B进行组合制取氯气,按要求回答下列问题:
实验室用如图所示装置A、B进行组合制取氯气,按要求回答下列问题: