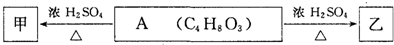题目内容
将1molSO2和1molO2通入一容积不变的密闭容器中,在一定温度和催化剂作用下发生反应 SO2(g)+
O2(g)?SO3(g).达到平衡后SO3为0.3mol,此时若移走0.5molSO2和0.5mol O2,则重新达到平衡后SO3物质的量为( )
| 1 |
| 2 |
| A、等于0.3mol |
| B、等于0.15mol |
| C、小于0.15mol |
| D、大于0.15mol,小于0.3mol |
考点:化学平衡的计算
专题:
分析:恒温恒容条件下,反应达到平衡时移走0.5molO2和0.5molSO2,达到新的平衡状态,该状态可以等效为开始加入时0.5molO2和0.5molSO2,所到达的平衡状态,与原平衡相比,减小了压强,平衡向逆反应移动,反应物的转化率降低.
解答:
解:将lmolSO2和lmolO2通入体积不变的密闭容器中,反应达到平衡时移走0.5molO2和0.5molSO2,达到新的平衡状态,该状态可以等效为开始加入时0.5molO2和0.5molSO2所到达的平衡状态,
与原平衡相比,压强降低,则化学平衡向逆反应移动,反应物转化率降低,若转化率不变时,生成的SO3的物质的量为:0.3mol×
=0.15mol,
由于转化率降低,故生成的SO3小于0.15mol,
故选C.
与原平衡相比,压强降低,则化学平衡向逆反应移动,反应物转化率降低,若转化率不变时,生成的SO3的物质的量为:0.3mol×
| 1 |
| 2 |
由于转化率降低,故生成的SO3小于0.15mol,
故选C.
点评:本题考查化学平衡的影响因素、等效平衡在化学平衡计算中的应用,题目难度中等,构建等效平衡是解题本题的关键,注意掌握化学平衡的影响因素.

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案
相关题目
下列过程属于人工固氮的是( )
| A、分离液态空气制氮气 |
| B、闪电时N2 转化为NO |
| C、合成氨 |
| D、豆科作物根瘤菌将N2 转化为NH3 |
下列有关工业生产的叙述正确的是( )
| A、合成氨工业中,将NH3及时液化分离有利于加快反应速率 |
| B、氯碱工业中,使用离子交换膜可防止Cl2和NaOH溶液反应 |
| C、硫酸工业中,接触室内安装热交换器,是为了利用沸腾炉中排出的SO2的热量 |
| D、硫酸工业中,SO2的催化氧化不采用高压,是因为压强对SO2转化率无影响 |
下列实验操作中错误的是( )
| A、进行蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 |
| B、进行萃取操作时,应选择有机萃取剂 |
| C、进行蒸发操作时,至当出现大量固体时,应停止加热用余热蒸干 |
| D、进行分液操作时,分液漏斗中下层液体从下口放出后,换一洁净烧杯继续接取上层液体 |
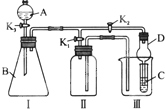 某兴趣小组的同学共同设置了如图所示的实验装置,既可用于制取气体,又可用于验证物质的性质.请回答下列问题:
某兴趣小组的同学共同设置了如图所示的实验装置,既可用于制取气体,又可用于验证物质的性质.请回答下列问题: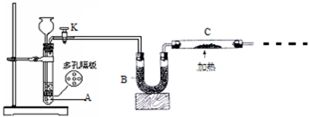 某化学课外活动小组拟用Zn和稀H2SO4制取H2还原CuO,实验装置如图.
某化学课外活动小组拟用Zn和稀H2SO4制取H2还原CuO,实验装置如图.